습열 노화 및 산소 유량이 마그네슘 파우더의 열 화학적 성질에 미치는 영향 조사
Copyright Ⓒ The Korean Society of Propulsion Engineers
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License(http://creativecommons.org/licenses/by-nc/3.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
초록
마그네슘은 충분한 에너지 밀도와 저렴한 가격으로 다양한 분야에서 사용되고 있다. 하지만, 마그네슘은 노화를 겪으면서 열화학적 성능 저하가 발생하는데, 아직 이것에 대해 밝혀진 바가 없었다. 습열 노화는 마그네슘에 열과 습기 모두 영향을 줘서, 마그네슘의 산화 반응을 지연시키는 산화 마그네슘과 가속시키는 마그네슘 수산화물로 이뤄진 산화막을 형성한다. 마그네슘 산화 반응은 표면 산화와 코어 산화로 이뤄지는데 장기 노화에서 산화막이 마그네슘 입자를 모두 둘러싸 표면 산화가 발생하지 않는다. 이로 인해, 장기 노화의 열 거동은 코어 산화의 열 거동과 유사한 형태를 가졌고, 낮은 반응률에서 높은 활성화 에너지를 형성했다. 게다가, 산소 유량이 증가하면서 마그네슘-산소 반응이 산소 부족 조건에서 산소 과다 조건으로 변화한다. 이러한 변화는 반응하는 마그네슘의 양을 증가시켜 더 높은 활성화 에너지를 유발했다. 따라서, 본 연구는 노화로 인한 마그네슘의 열화학적 성질 변화를 밝히고, 노화가 장기화될 때 생기는 현상을 규명했다.
Abstract
Magnesium is widely used in various fields due to its high energy density and low price. However, the degradation of thermochemical performance of magnesium subjected to hygrothermal aging has not yet been identified. Hygrothermal aging affects magnesium to form an oxide film consisting of magnesium oxide that retards the magnesium oxidation and magnesium hydroxide that accelerates it. The magnesium oxidation consists of surface oxidation and core oxidation. In long-term aging, the oxide film surrounds all magnesium surface, which results in the skip of surface oxidation. Because of this, the thermal behavior of long-term aged samples had a similar form to core oxidation, and form a high activation energy at a low reaction rate. In addition, as the oxygen flow rate increases, the magnesium-oxygen reaction changes from fuel-rich condition to fuel-lean condition. These changes increased the amount of magnesium that reacted, resulting in higher activation energy. Thus, this study investigated changes in the thermochemical properties of magnesium subjected to hygrothermal aging and identified the phenomenon that occurs when aging is prolonged.
Keywords:
Morphological analysis, Thermochemical analysis, Metal fuel, Magnesium, DSC, TGA키워드:
형상 분석, 열화학 분석, 고체 연료, 마그네슘, 시차주사열량계, 열중량분석기1. 서 론
석유, 석탄, 천연가스 등과 같은 화석 연료는 산업 현장에서 다양한 형태로 사용되고 있다. 하지만, 화석 연료는 타면서 이산화탄소를 배출하고, 매장량이 빠르게 줄어들고 있다는 단점을 가지고 있다. 세계적으로 화석 연료를 대체할 방안으로 태양열, 태양광, 풍력 등 다양한 시도를 하고 있다. 이 중에서 금속 연료는 화석 연료만큼 충분한 열에너지를 보유하고 있고, 이산화탄소의 배출 없이 사용할 수 있고, 산화-환원 반응을 통해 재사용이 가능하다는 점에서 화석 연료의 좋은 대안으로 연구되고 있다[1-2]. Julien 등[1]은 다음과 같은 제약 조건들을 적용하여 7개의 금속 (i.e. Mg, Al, Fe, B, Si, Ti, Zn)을 추려냈다: 1) 대기 중 산소와 반응할 수 있어야 한다; 2) 화석 연료만큼 높은 에너지 밀도를 가져야 한다; 3) 금속과 반응물이 독성, 방사성 물질이 아니어야 한다; 4) 반응하면서 이산화탄소 배출이 없어야 한다. Bergthorson은 화석 연료를 대체할 금속 연료를 찾고, 환경적 요인을 분석했다[2].
여러 금속 연료 중에서 마그네슘은 좋은 에너지 밀도를 가지고, 저렴한 가격으로 구할 수 있다는 점에서 화석 연료의 좋은 대안이 될 수 있다. 특히, 마그네슘은 추진제의 첨가물, 연료 전지, 열 저장소 등 다양한 분야에서 사용되고 있다[3-10]. Yuan 등[3]은 산소/질소 혼합 환경에서 마그네슘의 산화 특성을 연구했다. 그들은 질소 농도가 높아질수록 더 높은 온도에서 반응이 발생한다는 것을 발견했다. Oh 등[4]은 differential scanning calorimety (DSC)와 TGA를 사용하여 노화에 따른 마그네슘의 특성 변화를 연구했고, 노화는 마그네슘에 산화막을 형성하여 성능 감소를 유발한다는 것을 발견했다. 많은 연구들은 입자 크기에 따른 마그네슘의 반응 특성 변화를 조사했다[3-5]. Moser 등[5]은 순수 마그네슘의 입자 크기와 kinetics 사이의 상관관계를 조사했고, 작은 직경을 가질수록 빠르게 반응한다는 것을 발견했다. Nie 등[6]은 thermogravimeric analysis (TGA)를 사용하여 입자 크기에 따른 마그네슘의 산화 특성 변화를 연구했고, 마그네슘 입자가 고울수록 더 빠른 반응을 보였다. 마찬가지로, Cordova 등[7]은 입자 크기에 따른 마그네슘의 산화 반응과 kinetics를 조사했다. 마그네슘은 보통 혼합물이나 화합물의 형태로 많이 사용된다[8-10]. Soltani 등[8]은 알루미늄-마그네슘 혼합 파우더의 산화 과정과 화학 반응 인자들에 대해 조사했고, 활성화 에너지가 반응이 진행될수록 감소함을 발견했다. Shih 등[9]은 마그네슘과 마그네슘 합금에 생긴 산화막이 연소 메커니즘에 미치는 영향을 조사했다. Liu 등[10]은 마그네슘 합금들 (AZ31, ZE10, WE43)의 연소 및 열 특성을 조사했고, 세 합금 중에서 ZE10이 가장 높은 활성화 에너지를 형성했음을 밝혀냈다.
일반적으로 금속 연료는 보관하는 과정에서 열이나 주변 대기의 산소 및 습기와 반응하여 열 노화나 습열 노화를 유발한다 [4, 11-14]. Oh 등[11]은 다양한 습도 조건에서 노화된 지르코늄 포타슘 퍼클로레이트 (ZPP)의 열 특성을 조사했습니다. 노화된 ZPP는 산화제 농도 감소와 지르코늄 디옥사이드 농도 증가를 보였고, 높아진 상대 습도는 ZPP의 불발 가능성을 높였습니다. Oh 등[12, 13]은 여러 습도 조건에서 티타늄 하이드라이드 포타슘 퍼클로레이트 (THPP)를 노화시켜 생기는 열화학적 변화를 형상 및 열 분석을 통해 살펴봤습니다. Ambekar 등[14]은 여러 파이로 테크닉 조성물들의 열화학적 특성을 조사했습니다.
앞서 말한 것처럼 마그네슘은 다양한 분야에서 사용되고 있어 전략적으로 중요한 금속 연료 중 하나이므로 마그네슘의 노화와 관련된 연구가 절실합니다. 그러나, 마그네슘 (Mg)의 노화 메커니즘은 아직 밝혀지지 않았으며, 산소 유량과 마그네슘의 화학 반응 인자 사이 상관관계 또한 아직 밝혀지지 않았습니다. 따라서, 본 연구는 형상 분석 (SEM-EDS)와 열화학적 분석 (DSC, TGA)을 통해 마그네슘의 노화 메커니즘을 밝히고자 했습니다. 게다가, 산소 유량을 증가시켜 마그네슘의 열화학적 특성과의 상관관계를 조사했습니다. 마그네슘의 산화 반응은 표면 산화와 코어 산화로 이뤄져 있으며, 습열 노화는 대기에 있는 산소와 습기가 마그네슘과 반응하여 표면에 산화 마그네슘 (MgO) 및 마그네슘 수산화물(Mg(OH)2)을 형성합니다. 여기서, 산화 마그네슘은 마그네슘의 산화 반응을 지연시키는 반면에 마그네슘 수산화물은 반응을 가속시키는 역할을 합니다. 산화막의 형성은 보관 중에 발생하는 표면 산화로 노화가 장기화될수록 표면 산화가 많이 진행됐습니다. 마지막으로 산소 유량이 증가하면 반응하는 마그네슘이 많아져 높은 활성화 에너지로 나타났습니다. 따라서, 본 연구는 마그네슘의 노화 메커니즘에 대한 정보를 제공할 뿐만 아니라 산소 유량 조건에 대한 가이드라인을 제공합니다.
2. 실 험
2.1 마그네슘 파우더
본 연구에 사용된 마그네슘 파우더는 US Research Nanomaterials Inc.으로부터 공급받았으며, 99.9%의 고순도와 40 μm의 입자 크기를 가지고 있다. 또, 마그네슘 파우더에 적용된 노화 조건들을 Table 1에 정리했다.
일반적으로 금속 연료의 자연 노화는 오랜 기간이 소요된다. 따라서 본 연구에서는 단기간에 노화의 영향을 파악할 수 있도록 고온의 환경에 시료를 보관하는 ‘가속 노화’를 사용했다[4, 11-13]. 항공우주산업 표준에 의하면 고에너지 물질을 71 ℃ 조건으로 한 달 이상 보관하여 특별한 열화 반응이 발생하지 않으면, 3년 이상의 기대수명을 보장할 수 있다고 한다[15]. 따라서, 본 연구에서는 노화 시료들을 71 ℃ 오븐에서 3주 이상 보관하여 가속 노화 효과를 보고자 했다. 본 연구에 사용된 오븐은 강제 순환식 드라이 오븐으로 0.1 ℃의 정확도를 가진다. 또한, 습도의 영향을 파악하기 위해 대기 조건의 상대 습도를 유지했고, 습도계를 통해 상대 습도가 50에서 60% 사이로 유지되는 것을 확인했다. 마지막으로, 노화가 장기화 됨에 따라 생기는 변화를 살펴보기 위해 단기 노화 (3주, 5주)와 장기 노화 (25주)의 노화 기간을 설정했다.
2.2 형상 분석
Field-emission scanning electron microscope (FE-SEM)을 사용하여 마그네슘의 표면 형상을 확인했다. FE-SEM은 시료에 전자빔을 집중시켜 전자와 시료 간의 상호작용을 측정하여 고해상도 이미지를 얻는 장치로 JEOL Ltd의 JSM-7800F를 사용했다. 본 장치는 15 kV에서 0.7 nm, 1 kV에서 0.7 nm, 5 nA 및 5 kV에서 3.0 nm의 해상도를 가진다. 또, 시료에 고에너지 전자를 가하면 방출되는 X선을 검출하여 원자 구성을 파악하는 energy dispersive x-ray spectroscopy (EDS)가 FE-SEM에 부착되어 있어 원자 신호를 검출하는 데 사용했다.
2.3 열 분석 (DSC, TGA)
DSC는 시간 및 온도에 따른 레퍼런스 팬과 샘플 팬 사이의 열 흐름 차이를 측정하는 열 분석기로 Mettler Toledo의 DSC-3+를 사용했다. TGA는 시간 및 온도에 따른 시료의 중량 변화를 측정하는 열 분석기로 Mettler Toledo의 TGA 2를 사용했다. 두 실험 모두 1, 2, 3, 4, 그리고 5 ℃/min의 승온 온도와 50 ml/min 및 100 ml/min의 산소 유량을 사용했으며, 매 실험마다 0.3-0.5 mg의 시료를 사용했다. DSC는 30-630 ℃의 온도 범위를 가지며, 0.5 mm 직경의 구멍을 뚫은 뚜껑으로 덮은 standard 40 μL aluminum crucible에 시료를 담아 실험을 진행했다. TGA는 30-1100 ℃의 온도 범위를 가지며, 70 μL alumina crucible에 시료를 담아 실험을 진행했다.
마그네슘 발열 반응의 시작점과 끝점 사이에 sigmoidal 접선 타입 베이스라인을 긋고 발열 반응과 베이스라인 사이 면적으로 계산하여 마그네슘의 반응열을 계산했다. 시간에 따른 반응률은 식 (1)을 통해 계산하고, 식 (1)을 시간에 대해 미분하여 식 (2)를 얻을 수 있다.
| (1) |
| (2) |
여기서, t0, tend는 각각 반응 시작 시간과 반응 끝 시간이다. 또한, α(t), Q(t), B(t)는 각각 시간 t에서 반응 진행도, 열 흐름, 그리고 베이스라인의 데이터를 나타낸다.
추가적으로 Fraser-Suzuki 함수에 기반한 Advanced Kinetics and Technology Solutions (AKTS)-thermo-kinetics 소프트웨어를 사용하여 DSC 피크 분리를 진행했다.
2.4 Kinetics 계산
활성화 에너지 (Eα)와 빈도 인자 (Aα) 같은 화학 반응 인자들은 International Confederation for Thermal Analysis and Calorimetry (ICTAC)의 표준을 참고하여 계산했다[16, 17]. 선행 연구들에서 Friedman isoconversional method를 사용하여 고에너지 물질들의 화학 반응 인자들을 계산했고, 상당한 정확도를 가졌다 [4, 11-14]. 여기서, Friedman isonconversional method는 1/Tα,i vs ln (dα/dt)α,i 평면에서 직선의 기울기와 y 절편을 통해 활성화 에너지 및 빈도 인자를 구하는 방법으로 일정한 승온 온도를 가질 때, Eq. (3)의 형태를 가진다. 본 연구에서 선행 연구들과 동일한 형태의 방법론을 사용했으며, AKTS 소프트웨어를 사용하여 화학 반응 인자를 계산했다.
| (3) |
여기서, Eα, Aα, R, T, f(α), β는 각각 활성화 에너지, 빈도 인자, 상수, 온도, 반응 모델, 승온 온도를 의미한다. 본 연구는 마그네슘의 산화 반응에 의해 발생하는 발열 피크에 대한 화학 반응 인자를 계산했다.
3. 결 과
3.1 표면 형상 및 원자 신호
마그네슘은 노화를 거치면서 주변 산소 및 수분과 결합하여 산화 마그네슘과 마그네슘 수산화물로 구성된 산화막을 형성한다 [18]. 노화 과정에서 생성된 산화 마그네슘과 마그네슘 수산화물은 각각 다른 영향을 미친다. 산화 마그네슘은 마그네슘이 산소와 반응하는 것을 지연시키는 역할을 하고, 마그네슘 수산화물은 반응을 가속시키는 역할을 한다.
| (4) |
| (5) |
| (6) |
FE-SEM을 사용하여 비노화 및 노화 마그네슘의 표면 형상 분석을 진행한 결과 Fig. 1과 같은 결과를 얻을 수 있었다. 샘플 P의 SEM 이미지는 다른 샘플들에 비해 매끄러운 표면을 가지고 있는 반면에 노화 샘플들 (H-3, H-5, H-25)은 산화막이 형성되어 거친 표면을 가졌다. 특히, 장기 노화에 해당하는 샘플 H-25는 산화막이 마그네슘의 표면을 완전히 둘러싸 원래의 형상을 알아볼 수가 없었다.
추가적으로 EDS를 통한 원자 신호 측정 결과를 Fig. 2에서 확인할 수 있다. 단기 노화 샘플들 사이의 산소 신호는 큰 차이가 없었지만, 비노화에서 단기 노화로, 그리고 단기 노화에서 장기 노화로 변화할 때 큰 차이가 발생했다. 여기서 산소 신호는 산화 마그네슘과 마그네슘 수산화물을 의미하므로 노화가 진행될 때와 장기 노화가 될 때 많은 산화막이 형성됨을 알 수 있다.
3.2 TGA 결과
마그네슘은 노화 과정 중에 Eq. 4∼6과 같은 반응을 통해 산화막이 형성된다[19]. 노화 과정에서 생성된 마그네슘 수산화물은 약 300 ℃에서 산화 마그네슘으로 분해되고, Eq. 7은 이것을 나타낸다.
| (7) |
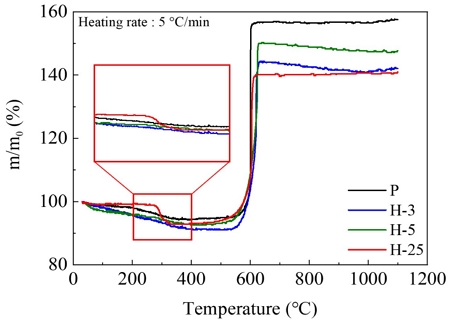
Figure 3은 비노화 및 노화 마그네슘의 중량 변화를 나타낸 TGA 결과이다. 모든 샘플들은 수분의 증발로 인해 질량의 감소가 발생했다. 또, 노화 샘플들은 노화 과정에서 생성된 마그네슘 수산화물이 약 300 ℃에서 분해되어 크게 중량이 감소했다. 특히, 샘플 H-25에서는 많은 마그네슘 수산화물이 형성되어 큰 질량 감소를 보였다. 온도가 약 500 ℃에 이르러서 마그네슘이 산소와 반응하기 시작하여 중량이 크게 증가했다. 비노화 샘플은 노화 샘플들에 비해 큰 증가폭을 보였으며, 장기 노화에 이르러서는 가장 적은 증가폭을 보였다. 이것은 노화가 장기화되면 마그네슘의 표면 산화가 거의 완료되어 코어 산화만 발생하기 때문이다.
3.3 마그네슘-산소 반응 (DSC)
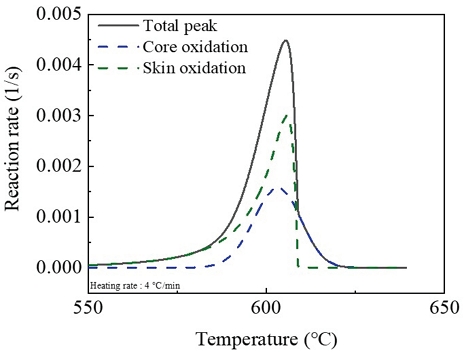
마그네슘의 산화 반응은 Fig. 4처럼 산소 유량에 상관없이 하나의 발열 반응을 가진다. 마그네슘의 발열 반응의 피크를 분리하면 Fig. 4와 같이 표면 산화와 코어 산화로 나눠진다. 표면 산화는 상대적으로 낮은 온도인 약 550 ℃에서 부터 서서히 반응이 시작되는 반면에 코어 산화는 거의 반응이 없다가 약 570 ℃에서 급격한 기울기를 가지고 반응이 진행된다.
Figure 5 (a)에서 비노화 샘플에 비해 단기 노화 샘플들은 상대적으로 높은 피크 온도를 가진 반면에 장기 노화 샘플은 비노화 샘플보다 상대적으로 낮은 피크 온도를 가졌다. 이것은 노화 과정에서 생성된 산화막의 종류와 양에 의해 발생했다. 단기 노화 샘플들은 Mg(OH)2에 비해 많은 MgO가 생성되어 마그네슘의 산화 반응이 상대적으로 높은 온도로 이동했고, 이것은 MgO가 마그네슘의 산화 반응을 지연시키는 역할을 하는 것을 의미한다. 그러나, 장기 노화 샘플은 단기 노화 샘픔들과 달리 Mg(OH)2가 MgO보다 많이 생성되었고, 마그네슘의 산화 반응이 상대적으로 낮은 온도로 이동했다. 이것을 통해 Mg(OH)2는 MgO와 달리 마그네슘의 산화 반응을 가속하는 역할을 함을 알 수 있다.
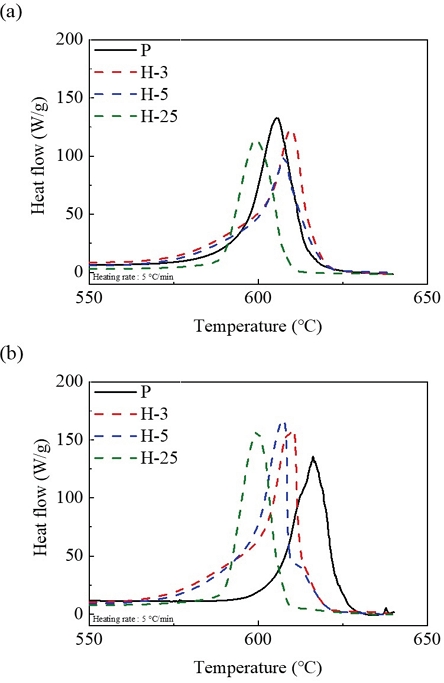
Exothermic peak of all samples (a) Oxygen flow rate of 50 ml/min (b) Oxygen flow rate of 100 ml/min.
게다가, 단기 노화 샘플들은 비노화 샘플과 유사하게 상대적으로 낮은 온도에서 반응이 서서히 진행됐다. SEM 이미지와 EDS 매핑에서 단기 노화 샘플들은 노화로 인해 생성된 산화막이 마그네슘의 표면을 모두 둘러쌀 정도로 진행되지 않았기 때문에 단기 노화 샘플들에서는 표면 산화와 코어 산화가 모두 발생했다. 반면에 장기 노화 샘플은 SEM 이미지와 EDS 매핑을 통해 산화막이 마그네슘 표면을 거의 완전히 둘러쌌다. 이것은 마그네슘의 표면 산화가 노화 과정에서 거의 종료되어 코어 산화만 발생함을 의미하며, 장기 노화 샘플의 열 흐름이 Fig. 4의 코어 산화와 유사하게 발생했다. 이것은 마그네슘의 노화가 장기화됨에 따라 표면 산화가 생략되고 코어 산화만 발생함을 의미한다. 이런 현상이 발생하는 이유는 마그네슘이 노화를 겪으면서 산화막이 형성되고 장기 노화에 이르러서는 산화막이 마그네슘의 표면을 완전히 둘러싸기 때문이다.
게다가, 산소 유량이 50 ml/min일 때는 모든 노화 샘플들의 열 강도가 150 W/g보다 작게 형성된 반면에 100 ml/min일 때는 150 W/g보다 큰 열 강도를 형성했다. 이것은 산소 유량이 증가하면서 더 많은 마그네슘이 산소와 반응하여 더욱 큰 발열 반응을 보였기 때문이다.
3.4 화학 반응 인자 분석
2.4절에서 설명했듯이 화학 반응 인자들은 1부터 5 ℃/min에서의 DSC 데이터에 Friedman method을 적용하여 계산했다. 반응 진행도가 0∼0.05 그리고 0.95∼1 사이에서 큰 실험 오차가 발생하므로 0.05∼0.95 사이의 데이터를 사용했다[14].
Figure. 6 (a)에서 활성화 에너지와 빈도 인자는 ‘키네틱 보상 효과’에 의해 유사한 변화 양상을 가졌다 [20]. 키네틱 보상 효과란 화학 반응 속도와 활성화 에너지 간의 관계가 온도 변화에 따라 변동할 때 나타나는 현상입니다. 일반적으로 활성화 에너지가 입자가 반응하기 위해 필요한 에너지로 반응 속도와 반비례하고, 빈도 인자는 반응 속도 상수의 크기를 결정하는 값입니다. 활성화 에너지와 빈도 인자가 상호 작용하면, 활성화 에너지의 증가로 인한 반응 속도의 감소를 상쇄할 수 있습니다. 이것을 수식으로 나타내면, 다음과 같습니다. 1/Tα,i vs ln (dα/dt)α,i 평면에서 활성화 에너지가 증가하면 Eq. 5의 기울기는 감소한다. 직선의 기울기가 감소함에 따라 y-절편은 증가하는데 이것은 빈도 인자의 증가를 나타낸다. 이런 활성화 에너지와 빈도 인자가 유사한 변화를 가지는 현상을 ‘키네틱 보상 효과’라고 한다[18].
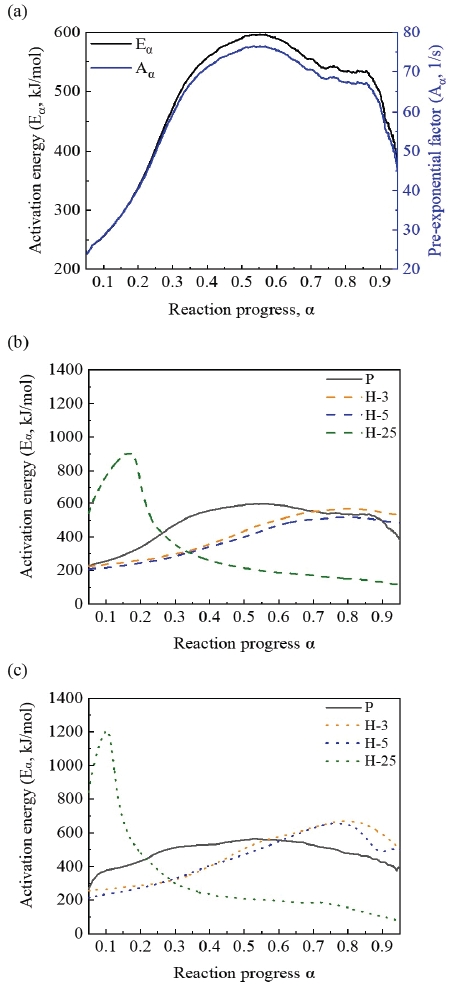
Calculated kinetics (activation energy, pre-exponential factor) (a) Kinetic compensation effect (b) Activation energy at oxygen flow rate of 50 ml/min (c) Actiavtion energy at oxygen flow rate of 100 ml/min.
또한, Moser 등 [5]은 본 연구와 유사하게 마그네슘의 활성화 에너지가 약 0.55의 반응률에서 피크에 도달했고, 본 연구의 비노화 샘플의 값보다 약 70% 감소한 186 kJ/mol이었다. 본 연구는 순수 산소를 퍼지 가스로 사용했지만 Moser 등의 연구는 산소-질소 혼합 에어 (산소 : 20%, 질소 : 80%)를 퍼지 가스로 사용했기 때문에 발생했다.
Fig. 6 (b)와 (c)는 각각 산소 유량 50 ml/min과 100 ml/min에서의 활성화 에너지를 나타낸다. 여기서, 단기 노화 샘플들이 비노화 샘플에 비해 높은 α에서 피크에 도달했다. 이것은 노화 과정에서 생성된 산화 마그네슘이 마그네슘-산소 반응을 감속시키는 역할을 하기 때문이다. 게다가, 장기 노화 샘플은 낮은 α에서 큰 활성화 에너지를 형성했다. 형상 분석과 열 분석을 통해 장기 노화 샘플은 표면 산화가 생략되고 코어 산화만 발생한다는 것을 알 수 있었다. 코어 산화는 표면 산화보다 상대적으로 높은 온도에서 급격하게 발생하기 때문에 낮은 α에서 큰 활성화 에너지로 나타났다. 마지막으로 모든 노화 샘플들은 산소 유량이 증가함에 따라 활성화 에너지가 증가했다. 이것은 3.3절에서 제시된 것처럼 더 많은 산소가 공급될수록 산소와 반응하는 마그네슘이 증가하고, 더 많은 마그네슘이 반응하기 위해서는 많은 에너지가 필요하기 때문에 발생하는 현상입니다.
4. 결 론
본 연구는 열과 습기가 마그네슘의 열화학적 특성에 미치는 영향을 파악하고 산소 유량이 마그네슘의 산화 반응에 미치는 영향에 대한 정보를 제공한다. 대기 조건에서 단기간 (3, 5주) 및 장기간 (25주) 동안 습열 노화를 진행했다. 5개의 일정한 승온 온도 조건을 실험에 적용하여 마그네슘의 열 거동을 살펴봤고, 열분석 데이터에 Friedman method를 적용하여 활성화 에너지와 빈도 인자 같은 Arrhenius 변수를 계산했다. 습열 노화는 마그네슘의 표면에 산화 마그네슘과 마그네슘 수산화물로 이뤄진 산화막을 형성했다. 산화 마그네슘은 마그네슘-산소 반응을 지연시켰고, 마그네슘 수산화물은 반응을 가속시켰다. 또한, 마그네슘의 산화 반응은 표면 산화와 코어 산화로 구성되고, 노화가 길어지면 코어 산화만 발생하여 반응 초기에 높은 활성화 에너지로 나타났다. 산소 부족 조건에서 산소 과다 조건으로 변화하면서 반응하는 마그네슘이 많아져 활성화 에너지의 증가가 발생했다. 이러한 활성화 에너지의 변화는 원래 의도했던 기능을 하지 못하게하여, 안전 문제를 유발할 수 있다.
Acknowledgments
[이 논문은 한국추진공학회 2023년도 춘계학술대회(2023.5.24.∼26, 라마다프라자 제주호텔) 발표논문을 심사하여 수정ㆍ보완한 것임.]
References
-
P. Julien, J. M. Bergthorson, Enabling the metal fuel economy: green recycling of metal fuels, Sustainable Energy & Fuels, 1, 3 (2017) 615-625.
[https://doi.org/10.1039/C7SE00004A]

-
J. M. Bergthorson, Recyclable metal fuels for clean and compact zero-carbon power, Progress in Energy and Combustion Science, 68 (2018) 169-196.
[https://doi.org/10.1016/j.pecs.2018.05.001]

-
C. Yuan, L. Yu, C. Li, G. Li, S. Zhong, Thermal analysis of magnesium reactions with nitrogen/oxygen gas mixtures, Journal of Hazardous Materials, 260 (2013) 707-714.
[https://doi.org/10.1016/j.jhazmat.2013.06.047]

-
J. Oh, Y. Lee, J. J. Yoh, On the oxidation kinetics of aging magnesium particles, Combustion and Flame, 249 (2023) 112597.
[https://doi.org/10.1016/j.combustflame.2022.112597]

-
G. Moser, V. Tschamber, C. Schönnenbeck, A. Brillard, J. F. Brilhac, Non-isothermal oxidation and kinetic analysis of pure magnesium powder. Journal of Thermal Analysis and Calorimetry, 136, 5 (2019) 2145-2155.
[https://doi.org/10.1007/s10973-018-7845-z]

-
H. Nie, M. Schoenitz, E. L. Dreizin, Oxidation of magnesium: implication for aing and ignition, The Journal of Physical Chemistry C, 120, 2 (2016) 974-983.
[https://doi.org/10.1021/acs.jpcc.5b08848]

-
S. Cordova, K. Estala-rodriguez, E. Shafirovich, Oxidation kinetics of magnesium particles determined by isothermal and non-isothermal methods of thermogravimetric analysis, Combustion and Flame, 237 (2022) 111861.
[https://doi.org/10.1016/j.combustflame.2021.111861]

-
M. Soltani, A. Seifoddini, S. Hasani, P. Rezaei-Shahreza, Non-isothermal kinetic analysis of the oxidation of Al–50Mg powder mixture, Reaction Kinetics, Mechanisms and Catalysis, 131, 1 (2020), 367-381.
[https://doi.org/10.1007/s11144-020-01845-1]

-
T. Shih, J. Liu, P. Wei, Oxide films on magnesium and magnesium alloys, Materials Chemistry and Physics, 104, 2-3 (2007) 497-504.
[https://doi.org/10.1016/j.matchemphys.2007.04.010]

-
C. Liu, S. Lu, Y. Fu, H. Zhang, Flammability and the oxidation kinetics of the magnesium alloys AZ31, WE43, and ZE10, Corrosion Science, 100 (2015) 177-185.
[https://doi.org/10.1016/j.corsci.2015.07.020]

-
J. Oh, S. G. Jang, J. J. Yoh, Toward understanding the effects of heat and humidity on ageing of a NASA standard pyrotechnic igniter, Scientific Reports, 9, 1 (2019) 1-12.
[https://doi.org/10.1038/s41598-019-46608-8]

-
J. Oh, J. J. Yoh, Critical changes in the ignition and combustion characteristics of aged titanium-based initiators, Combustion and Flame, 221 (2020) 74-85.
[https://doi.org/10.1016/j.combustflame.2020.07.037]

-
J. Oh, J. J. Yoh, Insights into aging mechanism of Ti-metal based pyrotechnics and changes in thermo-kinetic characteristics, Proceedings of the Combustion Institute, 38, 3 (2021) 4441-4449.
[https://doi.org/10.1016/j.proci.2020.08.040]

-
A. Ambekar, J. J. Yoh, Kinetics deconvolution study of multi-component pyrotechnics, Thermochimica Acta, 667 (2018) 27-34.
[https://doi.org/10.1016/j.tca.2018.07.007]

- American Institute of Aeronautics and Astronautics, Standard: Criteria for Explosive Systems and Devices on Space and Launch Vehicles (AIAA S-113A-2016), (2016).
-
S. Vyazovkin, A. K. Burnham, J.M. Criado, L.A. Pérez-Maquedac, C. Popescud, N. Sbirrazzuoli, ICTAC Kinetics Committee recommendations for performing kinetic computations on thermal analysis data, Thermochimica Acta, 520, 1-2 (2011) 1-19.
[https://doi.org/10.1016/j.tca.2011.03.034]

-
S. Vyazovkin, K. Chrissafis, M.L.D. Lorenzo, N. Koga, M. Pijolat, B. Roduit, N. Sbirrazzuoli, J. J. Sunol, ICTAC Kinetics Committee recommendations for collecting experimental thermal analysis data for kinetic computations, Thermochimica Acta, 590 (2014) 1-23.
[https://doi.org/10.1016/j.tca.2014.05.036]

-
M. Karimpour, S. R. Eatezadi, S. Hasani, A. Ghaei, The oxidation mechanism of pure magnesium powder particles: a mathematical approach, Metallugical and Materials Transactions B, 50, 40 (2019) 1597-1607.
[https://doi.org/10.1007/s11663-019-01588-y]

-
P. R. Hornsby, J. Wang, R. Rothon, G. Jackson, G. WIlkinson, K. Cossick, Thermal decomposition behaviour of polyamide fire-retardant compositions containing magnesium hydroxide filler, Polymer Degradation and Stability, 51, 3 (1996) 235-249.
[https://doi.org/10.1016/0141-3910(95)00181-6]

-
J. Zsako, The kinetic compensation effect, Journal of Thermal Analysis and Calorimetry, 9, 1 (1976) 101-108.
[https://doi.org/10.1007/BF01909271]