효율적인 제조 방법을 통한 비금속-펜타졸 염화합물의 합성
Copyright Ⓒ The Korean Society of Propulsion Engineers
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License(http://creativecommons.org/licenses/by-nc/3.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
초록
우수한 고에너지물질의 개발은 질소 함량이 높은 화합물을 합성하는 방향으로 진행되어 왔으며, 궁극적으로 폴리질소의 형태를 지향한다. 폴리질소의 한 가지인 cyclo-N5-가 합성되고 다양한 금속, 비금속 화합물의 형성 결과가 확인됨에 따라, 폴리질소 화합물의 활용 가능성이 주목받고 있다. 그러나 다양한 펜타졸 염화합물 합성의 시작물질인 NaN5의 알려진 합성조건이 매우 극단적이고, 정제 방법이 복잡한 만큼, 향후 pentazolate 화합물의 활용성을 높이기 위해서는 합성 및 정제 공정의 개선이 필수적이다. 본 연구에서는 NaN5 정제 방법을 단순한 여과 방식만을 적용하였으며, 이를 기반으로 두 가지 비금속-펜타졸 염화합물을 성공적으로 합성하였다.
Abstract
The development of excellent high-energy materials has progressed in the direction of synthesizing compounds with high nitrogen content, ultimately oriented toward the form of polynitrogen. As cyclo-N5-, a type of polynitrogen, is synthesized as sodium pentazolate(NaN5) and the results of various metal and non-metal compounds have been studied, the usage of polynitrogen compounds is attracting attention. However, since the known synthesis and purification method of NaN5 are very extreme and complicated, it is essential to improve the process in order to increase the utility of the pentazolate compounds in the future. In this study, only a simple filtration method was applied to purify the NaN5, and based on this, two non-metal pentazolate salt compounds were successfully synthesized.
Keywords:
High-Energy Density Materials, Polynitrogen, Pentazolate, Hydroxylammonium, Guanidininum키워드:
고에너지물질, 폴리질소, 펜타졸, 하이드록실암모늄, 구아니디늄1. 서 론
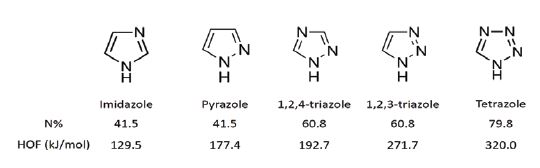
화약은 유도무기 체계의 위력을 결정하는 주요한 역할을 담당하는 요소로 임계 조건 이상에서 더욱 안정한 상태의 분자로 급격히 분해되며 에너지를 방출하고 이것이 폭발의 형태로 발현된다. 우수한 성능의 화약을 확보하기 위해서는 에너지밀도가 높은 고에너지물질의 개발이 기초가 되며, 이를 위해 질소 함량이 높은 분자를 설계하고 합성하는 것이 핵심이다[1-5]. 일반적으로 질소는 매우 높은 결합에너지(228 kcal/mol)를 지니는 삼중결합의 이원자분자(N≡N) 형태로 존재하므로, 단일결합(N-N, 39 kcal/mol) 또는 이중결합(N=N, 100 kcal/mol)의 질소가 포함된 분자의 경우, 분해 시 삼중결합의 이원자분자 상태로 변환되며 상당히 큰 에너지를 방출할 수 있다. 이를 위하여 나이트로(-NO2) 또는 아민(-NH2) 그룹 등을 도입하거나 질소가 포함된 고리형 분자를 기초로 한 화합물의 개발이 활발히 진행되어 오고 있다(Fig. 1).
분자 내 질소의 함량이 높을수록 더욱 큰 에너지밀도를 가질 확률이 높기 때문에, 고에너지물질의 개발은 일반적으로 다질소 화합물을 설계하고 합성하는데 주안점을 두고 있다. 궁극적으로는 질소만으로 이루어진 폴리질소(polynitrogen)를 확보할 경우, 기존의 화약 대비 상당히 큰 에너지밀도의 향상을 기대할 수 있을 것으로 판단되고 있다. 1999년 미국 공군연구소(AFRL)의 Karl O. Christe 교수 연구팀에서는 pentazenium 양이온(N5+) 화합물을 실험실 규모에서 합성하는데 성공하며 최초의 폴리질소 합성 및 활용에 대한 기대감으로 큰 주목을 받았다[6]. 이는 N5+AsF5- 등의 염화합물 형태로 만들어졌으며, 합성법을 개선하고 안정성을 확보하기 위한 후속연구가 진행되었으나, 큰 진전을 이루지 못하고 정체되었다[7-9]. 이후 답보 상태에 있던 폴리질소 관련 연구는 2017년 고리형 폴리질소인 cyclo-N5- 합성 결과가 발표되며 다시 활기를 띄고 있다. 중국 난징과학기술대학교(NJUST)에서는 저온 조건을 활용한 합성 기술을 적용하여(N5)6(H3O)3(NH4)4Cl 형태의 펜타졸 염화합물을 합성하고 구조를 분석하였으며[10], 이어서 [Na(H2O)(N5)]·2H2O 구조의 NaN5 화합물을 수백 mg 수준으로 합성하는데 성공하였다[11](Fig. 2).
이렇게 합성된 NaN5 화합물은 양이온의 치환을 통해 다양한 금속[12,13] 또는 비금속염[14-16]과 결합된 펜타졸 염화합물 형성의 기반이 된다. Cyclo-N5- 과 결합된 양이온의 종류 및 형성된 염화합물의 결정 구조 등에 따라 높은 에너지밀도와 안정성을 기대할 수 있으며, 비금속의 고질소 양이온 물질과 결합된 펜타졸 염화합물 중 일부는 상당이 우수한 성능을 보여준다[15].
이와 같이 폴리질소의 한 종류인 펜타졸 염화합물은 다양한 염화합물의 합성 및 결정 구조 연구 등을 통해 고성능과 안정성을 확보한 차세대 고에너지물질로 발전 가능성이 높은 것으로 평가된다. 다만, 펜타졸 염화합물의 활용 가능성을 높이기 위해서는 시작점이 되는 NaN5 화합물의 합성 공정 개선이 중요한 요소이다. NaN5의 합성 공정은 -40℃ 내외의 저온 반응 조건이 요구되며, 반응물에 비하여 상당히 많은 산화제(m-CPBA)가 투입된다. 이에 더불어 합성물의 정제를 위하여 액체-액체 추출, 컬럼 크로마토그래피, 재결정 등 상당히 까다로운 공정이 요구된다.
본 연구에서는 펜타졸 염화합물의 활용 가능성을 높이기 위하여 NaN5 화합물 합성의 복잡한 정제 공정을 개선하였으며, 이를 기반으로 AgN5 화합물을 거쳐 높은 폭속(D=9,005 m/s)을 지니는 것으로 알려진 NH3OH·N5[15]와 기존에 보고되지 않았던 Gu·N5 화합물을 합성하였다. 기존 선행연구에서 복잡한 절차를 통해 진행되었던 NaN5 화합물의 정제는 단순한 여과 방식을 통해 이루어졌으며, 다질소 염을 치환하는 실험 과정에서 잔여 불순물을 제거함으로써, 비금속 펜타졸 염화합물 합성 공정을 크게 개선하는 성과를 확보하였다.
2. 실험 방법
2.1 분석 방법
본 연구에서 화합물의 1H 스펙트럼은 400 MHz(Bruker ADVANCE 400) NMR(Nuclear Magnetic Resonance spectrometer)를 통해 측정되었으며 DMSO-d6가 용매로 사용되었다. IR 스펙트럼은 Thermo 사의 Nicolet iS10을 통해 측정하였다. HR-MS(High-Resolution Mass Spectra)은 Bruker 사의 microTOF-Q II모델을 이용하여 음이온모드로 측정하였다. TGA(Thermogravimetric analysis)는 Mettler Toledo 사의 TGA/DSC 3+ 장비에서 승온 속도를 5℃/min으로 적용하고 질소 환경으로 수행되었다. 원소분석의 경우 Thermo 사의 FlashEA 1112 원소분석 장비를 통해 수행되었다.
2.2 NaN5 화합물 합성
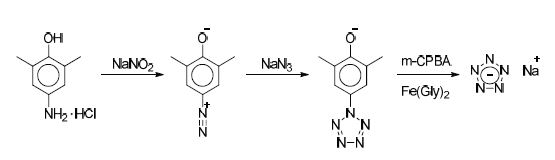
NaN5 화합물의 합성은 선행연구[11,17]에 기술된 방법을 참고로 하여 실험환경에 맞게 최적화하였으며, 합성을 통해 얻어진 4-Amino-3, 5-dimethylphenol을 시작물질로 한다. 먼저 얼음물 환경에서 4-Amino-3, 5-dimethyl-phenol 6.00 g(43.7 mmol)을 18 ml의 tetrahydrofuran 용매와 교반시킨다. 여기에 얼음물로 냉각시킨 염산(HCl, 37.2%) 9 ml(105 mmol)를 천천히 첨가한다. 약 15 분간 교반시킨 후, 물 10 ml에 3.17 g의 NaNO2(45.9 mmol)을 녹인 수용액을 한 방울씩 첨가한다. 얼음 배스 환경을 유지하며 추가로 30 분간 교반시킨 후, 냉각 시킨 methanol(MeOH, 50 ml)과 petroleum ether(PE, 100 ml) 혼합 용액을 첨가하고 저온 반응기에서 반응물의 온도를 -40℃ 이하로 냉각시킨다. 반응물의 온도가 -40℃ 이하로 냉각 되면 3.13 g의 NaN3가 용해된(48.1 mmol) 10 ml 수용액을 서서히 첨가한다. NaN3 용액이 첨가됨에 따라 arylpentazole이 형성되며 기포가 발생하는 것을 확인할 수 있다. NaN3 용액의 첨가가 완료된 후 -40℃를 유지하며 약 1 시간 반 동안 교반시킨다. 교반이 끝나면 -70℃로 설정된 냉동고를 활용하여 반응물을 여과시키고, 침전물을 냉동고에 저온으로 보관한 MeOH로 20 ml 씩 4회 세척한다.
세척한 침전물은 -47℃에서 진공 상태로 약 1 시간 동안 건조하며 이를 통해 붉은 빛이 도는 회색의 arylpentazole 고체를 51~58% 수율로 얻을 수 있다.
위의 과정을 통해 arylpentazole 4.83 g(25.4 mmol)이 얻어진 경우를 기준으로 다음 단계를 기술한다. 건조된 arylpentazole 고체를 -40℃에서 MeOH와 acetonitrile(AN)이 90 ml씩 혼합된 용액에 15 분간 교반시킨다. 여기에 합성을 통해 얻어진 iron(II) glycinate[Fe(Gly)2] 8.31 g을 첨가하여 30 분간 교반한다. 이 후 18.6 g의 meta-chloroperbenzoic aicd(m-CPBA)를 반응물에 조금씩 첨가하고 -40℃를 유지하며 20 시간 동안 교반시킨다. 반응시간이 종료된 후, 이를 여과하고 여과액을 회전증발농축기를 이용하여 건조시킨다. 건조 후 얻어진 고체에 200 ml의 ethyl acetate(EA)를 넣어 60 분간 교반시킨다. 이 과정을 2회 반복하고 얻어진 고체를 anhydrous EtOH(99.9%) 200 ml에 넣어 30 분간 교반하여 여과하고, 여과액을 회전증발농축기를 이용하여 건조시킨다. 얻어진 고체에 200 ml의 증류수를 넣어 30 분간 교반하여 여과하고 회전증발농축기로 건조하여, 유기 불순물과 합성 부산물인 NaCl이 제거된 NaN5 화합물 0.549 g(3.73 mmol, 14.6%)을 얻을 수 있다.
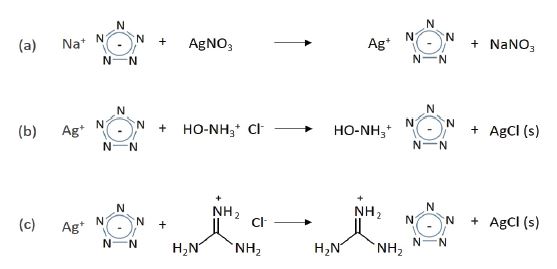
2.3 AgN5 화합물 합성
AgN5 화합물의 합성을 위하여 상기의 방법을 통해 얻어진 NaN5 화합물, [Na(H2O)(N5)]·2H2O 100 mg(0.680 mmol)을 5 ml의 물에 용해시키고 1 ml의 물에 용해시킨 AgNO3 119 mg(0.700 mmol)을 한 방울씩 첨가하였다. AgNO3 용액이 첨가되는 즉시 고체가 형성되며, 약 5 분간 교반시킨 후 여과함으로써 AgN5 89.0 mg(0.500 mmol, 73.5%)을 얻을 수 있다.
2.4 NH3OH·N5 합성
NH3OH·N5의 합성을 위하여 상기의 방법을 통해 얻어진 AgN5 48.0 mg(0.270 mmol)을 5 mL의 물에 넣고, 1 ml의 물에 용해시킨 NH3OHCl 13 mg(0.187 mmol)을 한 방울씩 첨가하였다. NH2OHCl 용액이 첨가되면 천천히 AgCl 고체가 형성되기 시작하고, 약 1 시간 상온에서 교반시킨 후 syringe 필터를 통해 여과액을 얻어서 농축함으로써 NH2OH·N5 16.0 mg(0.154 mmol, 57.1%)을 얻을 수 있다.
2.5 Gu·N5 합성
Gu·N5의 합성을 위하여 AgN5 64.0 mg(0.360 mmol)을 5 mL의 물에 용해시키고 1 ml의 물에 용해시킨 Guanidinium chloride 23.7 mg(0.248 mmol)을 한 방울씩 첨가하였다. Guanidinium chloride 용액이 첨가되면 천천히 AgCl 고체가 형성되기 시작하고, 약 1 시간 상온에서 교반시킨 후 Syringe filter를 통해 여과액을 얻어서 농축함으로써 Gu·N5 32.0 mg(0.246 mmol, 69.5%)을 얻을 수 있다.
3. 결과 및 고찰
3.1 NaN5 화합물 합성 결과
기존의 NaN5의 합성 방식에는 -40℃ 이하의 극저온 조건에서의 교반, 액체-액체 추출, 컬럼 크로마토그래피 정제, 재결정 공정 등 복잡한 과정들이 포함된다. 이 중에서도 액체-액체 추출, 컬럼 크로마토그래피 정제 공정은 생산규모를 키우기 매우 어려운 과정으로서, 장기적으로 펜타졸 염화합물의 활용성을 저해하는 주요한 요인으로 작용할 수 있다. 현재까지 다양한 펜타졸 염화합물의 합성은 NaN5가 기초가 되어 이루어지므로, NaN5의 합성 또는 정제 공정을 개선하는 것은 향후 폴리질소의 활용성을 높이기 위한 필수적 요소라 할 수 있다.
선행연구에서 사용한 컬럼 크로마토그래피와 재결정 정제 과정을 거쳐서 얻어진 NaN5는 순수한 결정으로 얻어지는데 비해, 필터 정제 공정만을 적용한 본 연구를 통해 얻어진 NaN5는 시료 내 불순물이 일부 존재한다는 단점이 있다. 그러나 NaN5는 그 자체로는 에너지 특성이 현저히 낮아 다른 염화합물로의 변환이 필요하며, 그 변환을 위해서는 AgN5라는 핵심 중간체를 거쳐야 한다. 따라서 비록 NaN5 단계에서 불순물이 일부 포함되어 있더라도 AgN5 합성과정에서 충분히 제거가 가능하다면, 본 연구의 합성/정제 공정은 대규모 생산을 고려하면 매우 효과적이며 편리한 제조 방법이 될 것으로 판단할 수 있다. 위의 아이디어를 바탕으로 AgN5를 합성한 결과, 개선된 정제 공정을 적용한 경우에도 AgN5가 잘 합성되는 것을 확인할 수 있었다.
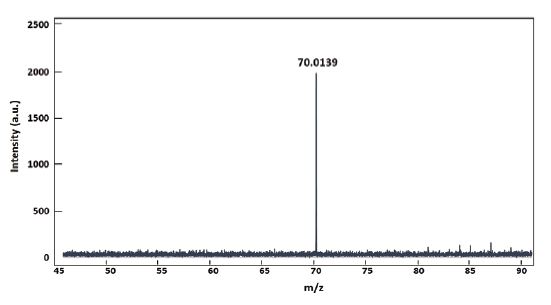
상기의 개선된 합성 및 정제 공정을 통해 NaN5 화합물이 형성되었는지 확인하기 위하여 고분해능 질량분석(HR-MS)을 실시하였다. 음이온 모드를 적용하여 측정하면, 컬럼 내에서 기화된 시료 중 형성된 음이온 분자들의 질량 값을 측정하게 된다. Fig. 3에서와 같이 고분해능 질량분석 결과 cyclo-N5-에 해당하는 질량값(m/z=70.0139)이 확인되었으며, 이는 일련의 실험 과정을 통해 NaN5 화합물이 성공적으로 합성되었음을 보여준다.
본 연구에서 NaN5 합성 공정의 시작물질인 4-Amino-3,5-dimethylphenol 6.00 g(43.74 mmol)을 투입하였을 때, 중간체인 arylpentazole 4.83 g(25.40 mmol, 58.06%)을 얻을 수 있었다. 여기에 안정제[Fe(Gly)2]와 산화제(m-CPBA)를 투입하여 NaN5 를 합성하고 EA와 99.9% EtOH를 이용한 여과 방식으로 정제함으로써, 0.549 g(3.73 mmol, 14.6%)의 NaN5를 확보하였다. 이렇게 확보된 시료에 대하여 열분석과 IR 분석을 실시한 결과, 열분석에서의 무게감량이 문헌에 비해 적어 소량의 불순물이 포함되어 있는 것으로 판단되었지만, 다양한 비금속 펜타졸 염화합물을 만들기 위한 시작물질인 AgN5를 합성하는 과정에서 정제가 가능할 것으로 생각되었다. 그것은 AgN5가 유기용매와 물에 대한 용해도가 매우 낮으므로 물과 아세톤으로 잘 씻어주면 불순물을 충분히 제거할 수 있을 것으로 판단했기 때문이다. 이에 따라 실험을 수행한 결과, NaN5에 포함된 불순물로 인하여 AgN5의 합성 시 수율저하가 일부 발생하지만 불순물이 제거된 형태로 얻어지는 것을 확인할 수 있었다. AgN5에 대한 합성결과 분석은 마찬가지로 IR과 열분석을 통해 진행되었으며, 열분석 패턴과 무게감량이 문헌과 일치하는 것으로부터 AgN5가 잘 합성된 것을 확인하였다.
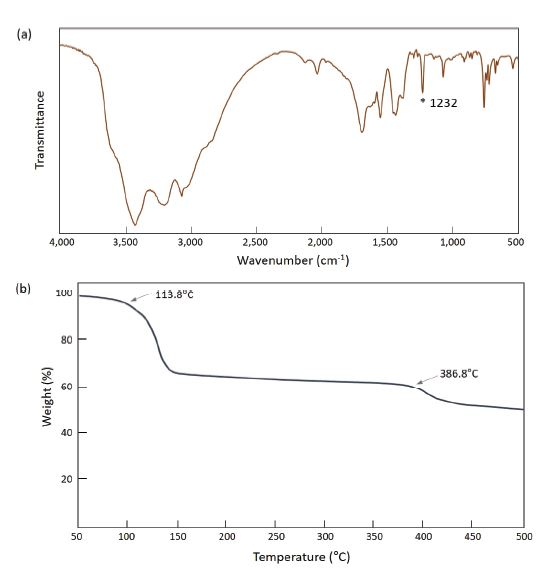
생성된 NaN5의 IR 및 TGA 분석을 실시한 결과는 Fig. 4와 같다. FT-IR 측정 결과 cyclo-N5-에 해당하는 흡광 스펙트럼이 1,234 cm-1 영역에서 확인되었다(Fig. 3a). TGA 분석 결과에서는 약 113.8℃에서 1차 분해가 시작되고, 386.8℃에서 2차 분해가 일어나는 것을 확인할 수 있었다(Fig. 4b). 선행연구의 TGA 결과와 비교해 볼 때, cyclo-N5-이 azide(N3-)와 N2로 분해되는 1차 분해 온도 111.3℃와 유사하게 나타나는 것을 확인하였으며 2차 분해는 410.1℃로 다소 차이를 보인다. 무게 감량의 경우 선행연구에서는 약 60%, 본 실험 결과에서는 약 50%로 합성된 시료 내 존재하는 불순물의 영향이 있는 것으로 보이나, 무게 감량과 분해 패턴을 비교 시 유사한 결과를 보이고 있어, NaN5 화합물이 비교적 잘 형성된 것으로 판단할 수 있다.
3.2. 비금속 다질소-펜타졸 염화합물의 합성 결과
NaN5의 합성은 다양한 펜타졸 염화합물을 확보할 수 있는 기반을 마련하였음을 의미한다. 앞서 기술한 바와 같이 다양한 펜타졸 염화합물 합성 및 분석에 관하여 진행된 선행연구를 결과를 살펴보면, 금속의 종류를 치환시킨 금속-펜타졸 염화합물의 경우, 3D 결정구조를 형성하는 등의 특징이 있지만 에너지물질로서의 우수한 성능을 발현하는데 한계가 있는 것으로 평가된다. 금속이 아닌 다질소 염이 결합된 비금속 다질소-펜타졸 염화합물의 경우 질소의 함량이 높아지고, 다질소 화합물과 폴리질소의 결합 효과로 인하여 상당히 우수한 고에너지 특성을 지니는 물질들이 발견되고 있다. 따라서 본 연구에서는 단순화한 정제 공정을 통해 합성된 NaN5를 적용하여 비금속 다질소-펜타졸 염화합물을 합성함으로써, 정제 공정 개선의 유효성을 확인하고 폴리질소 기반의 고성능 고에너지물질 개발 기술을 확보하고자 하였다. 이를 구현하기 위하여 NaN5의 금속염을 치환하여 AgN5를 합성하고 이를 이용하여 NH3OH 또는 Gu·N5 화합물을 합성하는 방법을 이용하였다(Fig. 5).
NaN5를 이용한 AgN5의 합성은 NaN5 수용액과 AgNO3 수용액을 5분간 혼합하고 여과하는 간단한 방법을 통해 얻을 수 있다(Fig. 4a). 비금속 펜타졸 염화합물을 합성하는 과정 역시 AgN5와 NH3OH 또는 Guanidinium chloride(Cl-)를 수용액 상에서 혼합하고 여과하는 간단한 과정을 통해 생성된다. 이 때 고체로 형성된 AgCl과 물이 용해되지 않는 유기 불순물이 걸러지고 여과된 용액을 농축시킴으로써 NH3OH·N5 및 Gu·N5 를 얻을 수 있다(Fig. 4b,c).
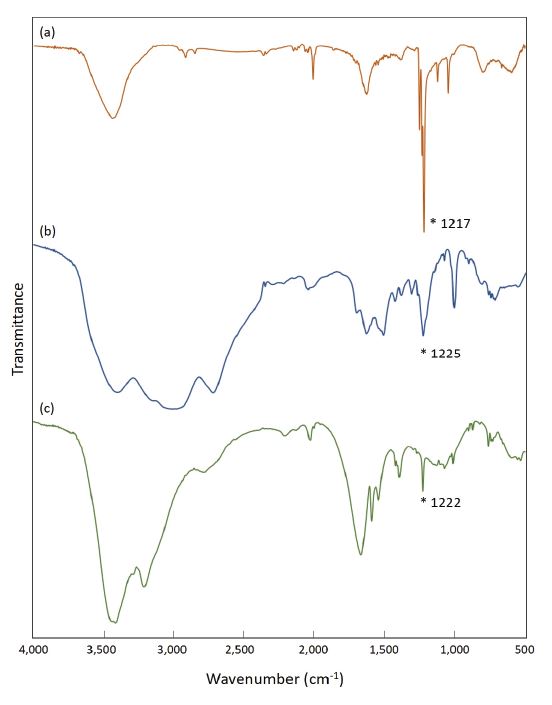
이렇게 얻어진 펜타졸 염화합물에 대한 분광 분석을 실시한 결과는 Fig. 5와 같다. 각 화합물에 대한 IR 측정 결과, NaN5 결과에서와 같이 cylco-N5-에 대한 흡광 신호가 뚜렷하게 관찰되었다: AgN5 1,217 cm-1, NH3OH·N5 1,225 cm-1, Gu·N5 1,222 cm-1(Fig. 5a-c). NH3OH·N5 및 Gu·N5의 경우, N-H 결합에서 발생하는 stretching vibration에 해당하는 흡광 신호가 각각 3,400, 3,440 cm-1에서 관찰되었으며, guanidinium에 포함된 C=N stretching 신호는 1,655 cm-1에서 확인되었다(Fig. 6b,c).
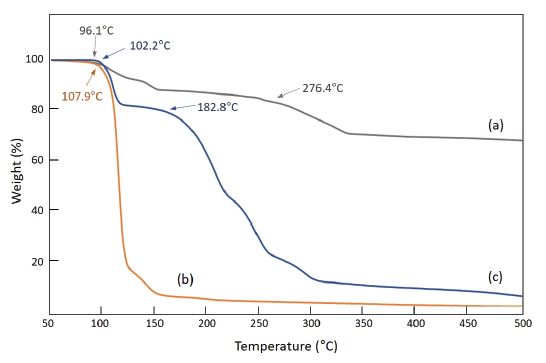
합성된 AgN5 및 NH3OH·N5, Gu·N5에 대한 열적 특성을 확인하기 위하여 TGA 분석을 실시하였다. TGA 분석은 50~500℃ 온도범위에서 이루어졌으며, 질소 분위기에서 승온 속도 5℃min-1 조건으로 진행되었다. 세 가지 시료는 각각 96.1, 107.9, 102.2℃에서 1차 분해가 시작되었으며 이는 NaN5의 경우에서와 같이 cyclo-N5-이 N3-와 N2로 분해됨으로써 나타나는 현상이다. AgN5의 경우, 1차 무게 감소가 진행된 후 200~330℃에 걸쳐 2차 분해가 진행되어 약 35%의 무게 감량을 보임으로써 선행연구 결과와 일치하는 열분해 패턴을 나타낸다(Fig. 6a). NH3OH·N5는 108℃ 부근에서 펜타졸 염화합물이 분해되는 무게 감소가 시작된 이후 용융이 일어나는 영역 없이 지속적으로 분해가 이루어졌으며 약 175℃ 부근에서 대부분의 무게 감소가 완료되어 선행연구의 결과와 일치하는 분해온도 및 패턴을 나타내었다(Fig. 7b). Gu·N5는 102℃ 부근에서 펜타졸 염화합물의 분해가 시작되고 300℃ 부근에서 무게 감소가 완료되는 패턴을 보여주었다(Fig. 6c). 앞서 보고된 바와 같이, 단순한 분자구조를 지니는 NH3OH·N5 화합물의 경우 100~170℃의 영역에서 분해가 대부분 완료된 반면, 탄소가 포함되어 있는 Gu·N5 화합물은 보다 넓은 영역인 90~300℃ 영역에 걸쳐 분해가 이루어지는 것을 확인할 수 있었다[15].
4. 결 론
다양한 펜타졸 염화합물 합성을 위한 시작물질인 NaN5는 까다로운 합성 조건과 복잡한 정제 과정으로 인하여 합성 규모를 확대하는데 한계가 있는 실정이다. 본 연구에서는 NaN5의 복잡한 정제 과정을 크게 단순화하여 개선하는 방법을 도입하였으며, 이를 통해 다른 펜타졸 염화합물을 합성하기에 충분한 수준의 NaN5를 확보하였다. 이렇게 얻어진 NaN5를 이용하여 AgN5를 합성하는 과정에서 불순물이 대부분 정제됨을 확인하였으며, 이를 기반으로 우수한 폭속을 지니는 NH3OH·N5와 기존에 보고되지 않았던 Gu·N5를 합성하여 폴리질소 기반 차세대 고에너지물질을 효율적으로 개발할 수 있는 기반기술을 확보하였다.
Nomenclature
| cyclo-N5- : | Pentazolate anion |
| NaN5 : | Sodium Pentazolate |
| AgN5 : | Silver Pentazolate |
| NH3OH·N5 : | Hydroxylammonium Pentazolate |
| Gu·N5 : | Guadinium Pentazolate |
Acknowledgments
본 연구 정부(방위사업청)의 재원으로 국방과학연구소의 지원(111155-911127202)을 받아 수행된 연구 결과입니다.
References
-
Hammerl, A., Klapötke, T.M., Nöth, H. and Warchhold, M., “[N2H5]+2[N4C-N=N-CN4]2-: A New High-Nitrogen High-Energetic Material,“ Inorganic Chemistry, Vol. 40, No. 14, pp. 3570-3575, 2001.
[https://doi.org/10.1021/ic010063y]

-
Klapötke, T.M. and Sabaté M., “Bistetrazoles: Nitrogen-Rich, High-Performing, Insensitive Energetic Compounds,” Chemistry of Materials, Vol. 20, No. 11, pp. 3629-3637, 2008.
[https://doi.org/10.1021/cm703657k]

-
Joo, Y.-H. and Shreeve, J., “1-Substituted 5-Aminotetrazoles: Syntheses from CNN3 with Primary Amines,” Organic Letters, Vol. 10, No. 20, pp. 4665-4667, 2008.
[https://doi.org/10.1021/ol8019742]

-
Joo, Y.-H. and Shreeve, J., “Energetic Mono-, Di-, and Trisubstituted Nitroiminotetrazoles,” Angewandte Chemie International Edition, Vol. 48, No. 3, pp. 564-567, 2009.
[https://doi.org/10.1002/anie.200804755]

-
Gao, H. and Shreeve, J., “Azole-Based Energetic Salts,” Chemical Reviews, Vol. 111, No. 11, pp. 7377-7436.
[https://doi.org/10.1021/cr200039c]

-
Christe, K.O., Wilson, W.W., Sheehy, J.A. and Boatz, J.A., “N5+: A Novel Homoleptic Polynitrogen Ion as a HIgh Energy Density Material,” Angewandte Chemie International Edition, Vol. 38, No. 13/14, pp. 2004-2009, 1999.
[https://doi.org/10.1002/(SICI)1521-3773(19990712)38:13/14<2004::AID-ANIE2004>3.0.CO;2-7]

-
Vij, A., Wilson, W.W., Vij, V., Tham, F.S., Sheehy, J.A. and Christe, K.O., “Polynitrogen Chemistry. Synthesis, Characterization, and Crystal Structure of Surprisingly Stable Fluoroantimonate Salts of N5+,” Journal of the American Chemical Society, Vol. 123, No. 26, pp. 6308-6313, 2001.
[https://doi.org/10.1021/ja010141g]

-
Wilson, W.W., Vij, A., Vij, V., Bernhardt, E. and Christe, K.O., “Polynitrogen Chemistry: Preparation and Characterization of (N5)2SnF6, N5SnF5, and N5B(CF3)4,” Chemistry A European Journal, Vol. 9, No. 12, pp. 2840-2844, 2003.
[https://doi.org/10.1002/chem.200304973]

-
Christe, K., Wilson, W.W., Vij, A., Vij, V. and Boatz, J.A., “On the Existence of FN5, a Theoretical and Experimental Study,” Journal of Physical Chemistry A, Vol. 107, No. 34, pp. 6638-6647, 2003.
[https://doi.org/10.1021/jp030157o]

-
Zhang, C., Sun, C., Hu, B., Yu, C. and Lu, M., “Synthesis and characterization of the pentazolate anion cyclo-N5- in (N5)6(H3O)3(NH4)4Cl,” Science, Vol. 355, No. 6323, pp. 374-376, 2017.
[https://doi.org/10.1126/science.aah3840]

-
Xu, Y., Wang, Q., Shen, C., Lin, Q., Wang, P. and Lu, M., “A series of energetic metal pentazolate hydrates,” Nature, Vol. 549, pp. 78-81, 2017.
[https://doi.org/10.1038/nature23662]

-
Xu, Y., Wang, P., Lin, Q. and Lu, M., “A carbon-free inorganic-metal complex consisting of an all-nitrogen pentazole anion, a Zn(II) cation and H2O,” Dalton Transactions, Vol. 46, No. 41, pp. 14088-14093, 2017.
[https://doi.org/10.1039/C7DT03231E]

-
Xu. Y., Lin, Q., Wang, P. and Lu, M., “Syntheses, Crystal Structures and Properties of a Series of 3D Metal-Inorganic Frameworks Containing Pentazolate Anion,” Chemistry an Asian Journal, Vol. 13, No. 13, pp. 1669-1673, 2018.
[https://doi.org/10.1002/asia.201800476]

-
Xu. Y., Lin, Q., Wang, P. and Lu, M., “Stabilization of the Pentazolate Anion in Three Anhydrous and Metal-Free Energetic Salts,” Chemistry an Asian Journal, Vol. 13, No. 8, pp. 924-928, 2018.
[https://doi.org/10.1002/asia.201800187]

-
Xu, Y., Tian, L., Li, D., Wang, P. and Lu, M., “A series of energetic cyclo-pentazolate salts: rapid synthesis, characterization, and promising performance,” Journal of Materials Chemistry A, Vol. 7, No. 20, pp. 12468-12479, 2019.
[https://doi.org/10.1039/C9TA01077G]

- Tian, L., Xu, Y., Lin, Q., Wang, P. and Lu, M., “Syntheses of Energetic cyclo-Pentazolate Salts,” Chemistry an Asian Journal, Vol. 14, No. 16, pp. 2877-2882, 2019.
-
Zhang, W., Wang, K., Li, J., Lin, Z., Song, S., Huang, S., Liu, Y., Nie, F. and Zhang, Q., “Stabilization of the Pentazolate Anion in a Zeolitic Architecture with Na20N60 and Na24N60 Nanocages,” Angewandte Chemie International Edition, Vol. 57, No. 10, pp. 2592-2595, 2018.
[https://doi.org/10.1002/anie.201710602]