DSC와 XPS를 통한 수분노화가 THPP 점화제에 미치는 영향 분석
Copyright Ⓒ The Korean Society of Propulsion Engineers
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
초록
Titanium hydride potassium perchlorate (THPP)는 항공우주분야에서 일반적으로 널리 사용되는 불꽃점화장치중 하나이다. 현 연구에서는 THPP에 수분 열 노화를 가했을 때, 연소과정에 끼치는 영향과 변화된 결과들을 실험적으로 밝혀내었다. 우선, Differential Scanning Calorimetry (DSC)와 isoconversional method를 적용하여 노화된 THPP 시료의 반응개시지연 및 최대반응속도의 저하를 확인하였다. 반응속도 파라미터는 첫 번째 반응에서 Viton에 의해 낮아지며 후에 잔류한 KClO4의 영향으로 상승하는 경향을 보였다. 그리고 X-ray photoelectron spectroscopy (XPS)를 통해 노화된 THPP 시료에서 산화제 성분은 감소하고 연료산화효과가 두드러짐을 확인하였다. 또한 NASA Chemical Equilibrium with Applications (CEA)을 사용하여 얻은 이론발열량이 DSC로부터 구한 실험적 발열량과 비슷한 경향을 따르므로 실험적으로 구한 발열량 트렌드가 타당함을 검증할 수 있었다.
Abstract
Titanium hydride potassium perchlorate (THPP) is one of the commonly utilized pyrotechnic materials in aerospace industries. The current study elucidates the effects of hygrothermal aging on the combustion of THPP experimentally. First, applying the Differential Scanning Calorimetry (DSC) and isocoversional method, both the delay of reaction start and decrease in maximum reaction rate were observed. The kinetics parameters tended to fluctuate depending the thermal reaction or intermediate product formation of THPP. Also, the oxidants decomposition and fuel oxidation phenomenon were discovered by X-ray photoelectron spectroscopy (XPS). The experimental heat from DSC data were verified as reasonable by comparing with the theoretical heat obtained utilizing both THPP formulation from XPS and NASA Chemical Equilibrium with Applications (CEA). Both data had identical variation trend, which expecially had the highest heat value at 10 weeks aged sample.
Keywords:
Hygrothermal aging, Differential Scanning Calorimetry, Aging prediction, Titanium hydride potassium perchlorate키워드:
수분 열 노화, 시차 주사 열량 측정법, 노화 예측, THPP1. 서 론
Pyrotechnic 물질과 같은 고에너지물질의 성능은 연소 과정 및 이와 관련된 화학반응속도에 직접적으로 영향을 받는다. 그런데 이러한 물질을 장기간 보관 또는 운송 시 표면 및 입자계면에서의 미세한 균열현상과 같은 노화효과로 인해 성능저하를 초래할 수 있다. 이외에 또 다른 성능저하로는 발화 실패, 지속적인 연소 불가, 또는 감소된 발열량 등의 요소들로 발현될 수 있다[1, 2]. 따라서 점화제와 같은 물질들의 노화 효과를 분석하고 이에 따른 성능저하를 예측함으로써 최적화된 보관조건을 도출할 수 있을 것이다. 그 결과 성능저하를 초래할 수 있는 온도 및 습도 조건을 주의하여 보관함으로써 추후에 발생할 수 있는 문제들을 효과적으로 줄여줄 수 있다.
본 연구에서 사용된 Titanuum Hydride Potassium Perchlorate (THPP)는 급속 연소에 의해 유도된 압력을 사용하여 점화시키는 pyrotechnic initiator로써, 우주항공 및 추진 산업에서 일반적으로 사용되는 물질로 정의할 수 있다[3]. 현재 이러한 THPP와 같은 고에너지 물질의 노화를 이해하기 위한 다양한 연구가 진행되고 있으며, 특히 Differential Scanning Calorimetry (DSC)를 사용한 노화분석이 활발하게 이루어지고 있다.
이 때, 보다 정확한 노화분석이 이루어지기 위해서는 성능과 특성을 나타내는 파라미터들에 대한 분석이 이루어져야한다. 보통 학계에서는 온도에 따른 열 유량을 나타내는 DSC 데이터로부터 1-step으로 이루어진 반응에 대해 활성화 에너지와 빈도인자로 구성된 kinetics parameter를 구해왔다. 보통 이러한 특성 파라미터는 성능을 나타내는 반응속도와 시료에 대한 수명예측을 산출할 수 있다. 따라서 이러한 특성 파라미터를 구하는 것이 노화 과정을 이해하고 분석하는 데 중요한 과정이라고 할 수 있다.
관련 연구로는 Wang 등[1] 연구진이 pyrotechnic mixture의 수분 열 효과가 작용할 때의 폭발임계온도와 활성화 에너지를 구해 해당하는 변화를 보며 열안정성에 대해 분석한 사례가 있으며, Sorensen 등[4]은 열 노화된 THPP 시료에 대해 등온 조건으로 DSC와 high-resolution thermogravimetry (TG) 기법을 통해 동역학적 파라미터를 얻어 연구 분석을 진행하였다. Trache 등[5]은 nitrocellulous와 nitroglycerin으로 구성된 이중추진제의 수명을 예측하기 위해서 DSC 실험을 수행, Ozawa와 Kissinger 방법을 적용하여 각각의 방법에 해당하는 반응속도 파라미터를 구하고 비교해보며 열분해와 성능예측연구를 진행하였다.
본 연구에서 사용한 TiH2와 KClO4 혼합추진제 다시 말해, THPP 조성물은 제품을 개발 할 때 개별적으로 생산되는 것이 아니라 대규모로 대량 생산되기 때문에 생산 중에 온도 및 습도 조건 에 영향을 받을 수 있으며, 오랜 기간 동안 보관될 수 있다. 따라서 THPP 노화를 다룰 때에는 온도와 습도 모두 고려해야 하지만, 열 수분 노화를 다룬 연구는 드문 편이다.
현재 본 논문에서는 THPP 성분에 대해 실험적으로 도출한 열 수분 노화의 영향과 효과에 대해 기술하고 있다. 일반적으로 pyrotechnic 물질의 노화에 대한 대부분의 연구는 가속 노화 실험과 특정 분석기법을 함께 사용하여 분석을 진행하고 있다[6]. 현 연구와 기존연구와의 큰 차이점은 추가적으로 진행한 spectroscopy 데이터를 DSC 기법과 결합하여 노화효과를 추론한 것을 들 수 있다.
본 연구에서 수행된 DSC 기법은 소량의 샘플을 사용하지만, 보다 정확한 chemical kinetics를 도출해낼 수 있는 큰 장점을 가지고 있는 연구라고 할 수 있다. 전형적인 DSC 분석은 설정 온도범위에서 반응하는 샘플의 열 유량의 변화, 발열량, 즉 화학반응과 관련된 샘플의 동태를 관찰함으로써 이루어진다. 또한 X-ray photoelectron spectrometer (XPS)는 시료 표면의 정성 및 정량에 대한 정보를 얻기 위한 가장 단순하고 정확한 방법[7]으로, 본 연구에서는 각 THPP시료에 대한 정성, 정량 분석이 이루어졌다. XPS 데이터를 통해 구한 각 THPP 샘플의 조성을 NASA CEA program에 대입하여 계산한 이론발열량을 DSC를 통해 구한 발열량과 비교하여 경향성을 확인해보았다.
노화되지 않은 THPP와 노화된 THPP에 대한 반응속도상수는 differential isoconversional Friedman method[8]를 사용하여 구하였다. 본 방법은 동역학적 파라미터를 구하는데 있어서 가장 널리 알려진 방법 중 하나로, 단일 스텝에서의 계산뿐만 아니라 모든 반응구간에 해당하는 파라미터들을 계산해낼 수 있다[9, 10, 11]. 이때, 활성화 에너지와 같은 반응속도 파라미터는 물질에 대해 단일 값을 갖지 않고 물질의 조성과 발생하는 화학반응에 따라 그 값이 변동하게 된다. 따라서 본 방법을 적용하여 모든 반응구간에 해당하는 파라미터들을 추출하여 더욱 더 정확한 반응속도 파라미터 분석을 이끌어내었다.
요약하자면, 본 연구는 THPP 시료에 대해 수분 열 노화가 끼치는 영향과 효과 분석 및 시료보관 조건의 중요성을 밝히는 것을 목적으로 하고 있다. 뿐만 아니라, THPP 샘플연소 시 발생하는 화학반응에 대해 자세하게 기술하고, 모든 반응구간에 대한 kinetics parameter를 도출해내어 화학반응 상태론 적으로도 결과를 이끌어 내었다. 그리고 DSC 실험과 XPS 실험을 통해서 수분 열 노화 반응에 대한 영향을 파악하고, 변화정도를 정량화할 수 있었다. 이를 토대로, 노화된 THPP 시료들에 대한 실험적 반응열 경향을 NASA CEA 코드를 사용하여 구한 이론값과 비교해보면서 타당성을 입증하였다.
2. 실 험
2.1 사용된 노화 물질
본 실험에서 사용된 THPP 물질은 파우더 형태로 되어있으며, 질량 기준으로 32%의 TiH2, 63%의 KClO4와 5%의 Viton-b로 구성되어있다. Table 1은 THPP 시료에 대한 노화조건을 나타내고 있다. 노화조건 중, 노화 온도는 미국항공 우주학회[12]의 가이드라인을 참고하여 71 ℃로 설정하였다. 반면에 상대습도는 100%로 상당히 높은 값을 가지는데, 그 이유는 높은 상대습도 조건에서 수분이 시료에 끼치는 영향을 극명하게 관찰할 수 있기 때문이다[13, 14]. 그리고 편의상 각 샘플은 Table 1에 표기된 일련의 숫자(#n)로 대체하여 부르기로 한다.
2.2 DSC 실험
각 샘플에 대한 열량측정 실험은 Mettler Toledo사의 DSC-3+을 통해 진행되었다. 가열속도는 0.5, 1, 2, 4 ℃/min으로 총 4가지 종류로 구성되어있으며, 가열온도범위는 30 ℃에서 600 ℃이다. 또 외부공기와의 반응을 차단하기 위해 85 ml/min의 질소유량을 흘려보내주었다. 그리고 DSC 실험 중 시료질량이 과다하거나 가열속도가 높은 경우 자기가열효과가 발생하여 정상적인 실험 측정에 영향을 끼칠 수 있기 때문에[15, 16], 이러한 문제가 발생하는 것을 막기 위해서는 적절한 조치를 취해주어야 한다[17]. 따라서 본 논문에서는 자기가열현상을 억제하기 위해 각 실험에 사용된 mg 단위의 시료 질량(m)은 각 실험의 가열속도(β)와 곱한 값이 1 이하라는 관계식을 사용하여 결정되었다. 이 때, 각 실험마다 샘플질량이 변화하더라도, 실험 중 자체가열현상이 없으며 각 가열속도마다 균일한 발열량을 얻을 수 있기 때문에 DSC 실험은 질량에 독립적이라고 할 수 있다.
팬은 40μL standard pierced aluminium pan을 사용하였다. THPP와 같은 고에너지물질의 경우, 가열시킬 때 화학반응을 일으키기 위해 전도되는 열보다 가열되면서 물질자체에서 기화되는 열이 더 크기 때문에 팬을 개방시킨 채로 실험하기보다는 lid에 0.1mm의 지름으로 된 구멍을 뚫어 밀폐한 후 실험을 수행하였다. 마지막으로, 본 논문에서는 각 샘플에 대한 반복성을 입증하기 위하여 모든 시료에 대해서 적어도 3번 이상 반복실험을 진행하였다.
2.3 XPS 실험
실험에 앞서 THPP 샘플이 파우더시료이기 때문에 SPEX Sampleprep사의 자동 유압식 가압기(3635 X-Press)와 파라핀 바인더를 사용하여 pellet을 제작하는 전처리 과정을 거쳤다. 그리고 THPP 시료의 화학적 조성 및 정량적 값은 micro focused monochromatized Al Kα X-ray sources (1486.6 eV)와 구형분석기가 장착된 영국의 VG Company의 Sigma Probe SYSTEM X-ray 광전자 분광기로 측정되었다.
3. 결과 및 논의
3.1 DSC 열분석도
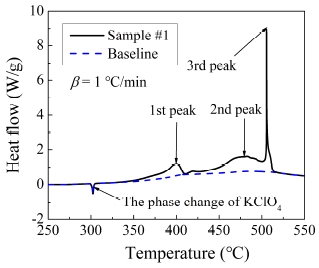
Fig. 1은 가열속도가 1 ℃/min 일 때에 sample #1에 대한 열분석도를 나타낸다. Baseline은 반응시작 및 끝점에 대해 sigmoidal tangential mode로 설정하였고, THPP 시료는 한 개의 흡열피크와 세 개의 발열피크로 구성되어있다. 300 ℃ 부근의 흡열피크는 KClO4가 사방형에서 입방형으로의 상변화를 나타낸다[4]. 그리고 TiH2와 KClO4의 화학량론적 반응의 경우[18], 541.5 ℃ 부근에서 한 개의 발열피크가 발생했다고 보고되었다.
더 자세한 피크 분석에 앞서서, 앞선 연구들의 연구동향을 살펴보면 Kai-Tai 등[19]은 DSC와 TGA를 이용하여 완속 가열시 Viton 첨가유무에 따른 텅스텐-과염소산칼륨의 반응특성에 대해 연구를 하였다. 해당 연구는 Viton을 첨가하였을 때, 반응 초반에 새로운 발열반응이 등장한 것을 DSC 열분석도로 발견하였다. 따라서 해당 연구에서 첫 번째 발열피크는 텅스텐과 과염소산칼륨 그리고 Viton으로부터 발생한 반응을 나타내었지만, 두 번째 발열피크는 Viton을 제외한 나머지 물질들에 의한 반응이라고 제안하였다.
따라서 본 연구에서 350~400 ℃ 부근에서 나타나는 첫 번째 발열피크는 Kai-Tai 등[19]과 비슷한 경우로써, TiH2, KClO4와 Viton의 반응으로 발생한 피크라고 가정할 수 있다. 그리고 450 ℃~500 ℃ 부근에서 발생하는 비교적 넓은 범위의 두 번째 발열피크는 Viton을 제외한 나머지 물질들의 반응이라고 여길 수 있다.
이때 두 번째 발열반응 구간에서 산화제인 KClO4가 분해반응을 일으켜 생성된 KClO3와 O2로 인해 TiH2가 산화반응을 일으켜 TiO2가 생성될 수 있다.
그런데 이때, TiO2와 같은 금속산화물이 KClO3와 함께 존재할 때, KClO4의 생성을 촉진하는 역할을 할 수 있다고 Rudloff 등[20]이 연구한 바가 있다. 따라서 TiO2의 촉매반응으로 인하여 주요반응이 완료되었다고 하더라도, KClO4가 잔류할 가능성이 있다는 것을 알 수 있다. 따라서 504 ℃ 부근의 세 번째 발열피크는 남아있던 KClO4의 발열반응이라고 볼 수 있으며, 비슷한 결과가 Sorensen 등[4]에 의해 보고된 바 있다.
DSC를 통해 본 샘플들의 열분석도에 기초해보면, THPP 시료연소의 반응과정은 다음과 같이 크게 3가지의 반응 순서로 나타낼 수 있으며, 다음과 유사한 반응과정이 다른 곳에서도 보고가 된 바가 있다[4, 19, 20].
- 1. KClO4의 상변화 반응
- 2. TiH2, KClO4와 Viton의 발열반응
- 3. Viton을 제외한 발열반응+KClO4 합성반응 (TiO2의 촉매효과)+잔류한 KClO4 발열반응
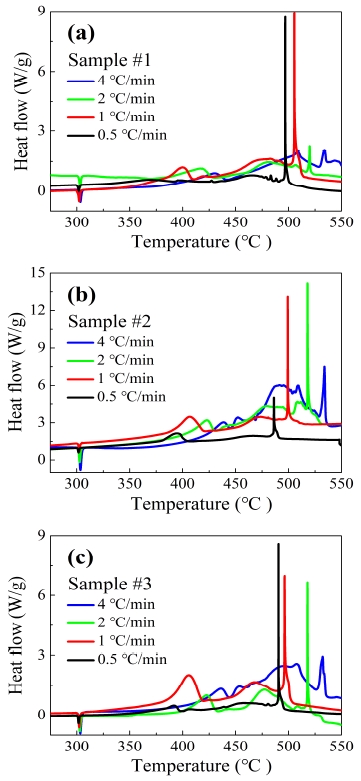
Fig. 2는 4개의 다른 가열속도 (0.5, 1, 2, 4 ℃/min)에서 실험된 모든 THPP시료에 대한 DSC 열분석도를 나타낸다. 실험결과 모든 발열구간의 반응시작부분과 반응종료부분이 가열속도가 높아질수록 높은 온도에서 반응한 것을 볼 수 있는데, 이는 물질 그 자체의 특성을 나타내는 가역과정이기 때문이다. 반면, 300 ℃ 부근에서 KClO4의 상변화를 나타내는 흡열피크는 가열속도에 상관없이 일정함을 볼 수 있다. 그리고 Fig. 2(b)의 열유량은 다른 샘플들에 비해 높은 값을 가지는 것을 볼 수 있다. 이때, 샘플 #2에 혹 자체가열효과가 관여하였다고 추정할 수 있지만, 샘플 자체의 thermal gradient에는 영향이 없었기 때문에 단순히 발열반응이 다른 샘플들에 비해 크다는 것을 보여주는 것이라고 할 수 있다.
Table 2는 다양한 가열속도에서의 THPP 시료의 각 발열피크와 반응개시온도 값을 보여줌으로써, 수분 열 노화로 인한 THPP의 열적 거동을 확인할 수 있다. 이때 반응개시온도는 DSC로부터 구한 온도에 따른 열류량 데이터를 1차 미분한 값의 변화를 기준으로 측정하였다.
먼저, 첫 번째 발열피크의 온도가 높아지는 경향을 보였다. 반면, 두 번째 발열피크와 세 번째 발열피크는 노화가 진행될수록 대체로 낮은 온도로 이동하는 경향을 보였다.
발열피크와 반응개시온도에서의 차이는 노화가 되지 않은 샘플과 노화된 샘플사이에서는 극명하게 드러났지만, sample #2와 sample #3의 발열피크는 비슷한 온도를 가졌다. 하지만 sample #2와 sample #3의 반응개시온도는 노화가 진행될수록 높아지는 추세를 보여주었다. 따라서 THPP 시료에 수분 열 노화를 가할 시 반응개시를 늦춘다고 추정할 수 있다.
3.2 반응속도 및 파라미터 추출
각 샘플의 DSC 열분석도에 해당하는 활성화 에너지와 pre-exponential factor와 같은 반응속도상수는 Friedman isoconversional method[7]를 적용하여 계산하였다. 선례로 Kim 등[6]이 Friedman isoconversional method를 사용하여 고에너지물질의 전체반응에 대한 반응속도 파라미터를 추출하였는데, 그 결과는 상당한 정확도를 갖는 것으로 확인되었다. 본 논문에서 사용한 방법론은 Kim 등[6]이 사용한 방법론과 동일한 형태를 가지며, AKTS software를 사용하여 baseline, 반응속도, pre-exponential factor 및 반응열 값을 측정하였다.
본 논문에서는 첫 번째와 두 번째 발열피크에 대한 반응속도상수를 구하였다. 그 중에서, 모든 세 개의 반응들 중에서 두 번째 발열반응은 가장 높은 반응열을 가졌기 때문에, 본 논문에서는 두 번째 발열반응을 THPP 시료의 주요반응으로 간주하였다. 따라서 반응속도상수를 분석하기에 앞서, 각 시료에 대한 두 번째 발열피크에 대해서만 반응속도 경향 분석을 진행하였다.
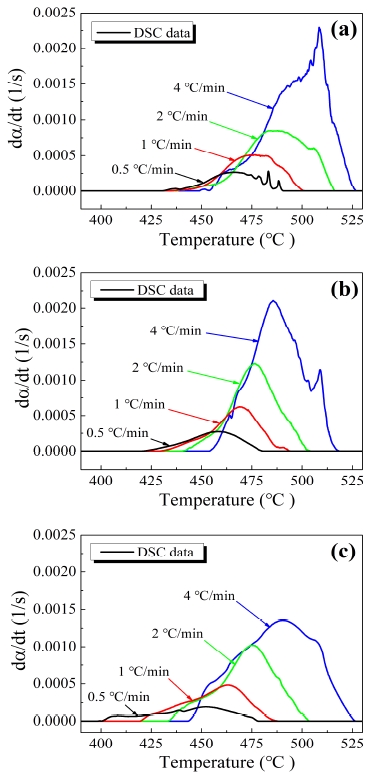
Fig. 3은 DSC 실험을 통해 구한 각 THPP 시료의 두 번째 피크에 해당하는 반응속도를 나타낸 그래프이다. Table 3에서도 볼 수 있듯이 모든 샘플에 대해서 가열속도가 증가할수록 반응피크온도(Tr,p)와 최대반응속도((dα/dt)max)가 높아지는 경향을 보였다. 그런데 수분 열 노화가 가해졌을 때, 반응피크온도는 낮아졌으며 노화일수가 진행될수록 더욱 더 낮아지는 경향을 확인할 수 있었다. 최대반응속도는 수분 열 노화가 가해졌을 시에 10주 노화 시킨 샘플에서는 증가하다가 12주 노화시킨 샘플에서 감소하는 경향성을 보였다. 따라서 수분 열 노화가 THPP 시료의 최대반응을 더 낮은 온도에서 발생하도록 하지만, 최대반응속도는 샘플 #2에서 가장 빠르고 이보다 더 노화될 시 느려지게 함을 알 수 있다.
Fig. 4는 isoconversional Friedman method를 적용하여 구한 반응진행정도에 따른 반응속도상수인 활성화 에너지와 pre-exponential factor의 동향을 나타내고 있다.
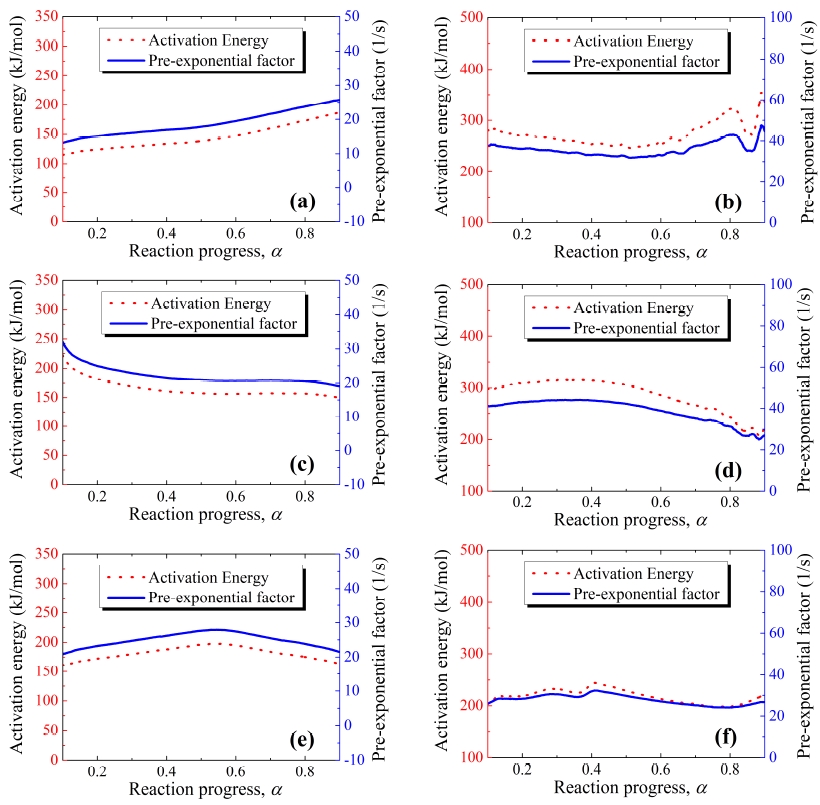
Kinetics parameters of THPP: (a) sample #1 at 1st peak, (b) sample #1 at 2nd peak, (c) sample #2 at 1st peak, (d) sample #2 at 2nd peak, (e) sample #3 at 1st peak, (f) sample #3 at 2nd peak.
본 논문에서는 세 번째 피크반응이 가열속도마다 불규칙적인 결과로 인해 신뢰도가 낮은 반응속도 파라미터 데이터를 얻을 수밖에 없었기 때문에 앞의 두 반응에 대한 반응속도파라미터만 구하였다.
그리고 반응시작과 끝에서 오차가 컸기 때문에 반응진행정도를 나타내는 α (reaction progress)값의 범위를 0.2에서 0.8로 설정하였다. 활성화 에너지와 pre-exponential factor는 열 습도 노화가 가해졌을 때, 그리고 노화일수가 연장될수록 높아지는 경향을 보였다. Sample #1의 활성화 에너지는 123.60~172.74 kJ/mol의 값을, pre-exponential factor는 15.05~23.00 /s의 값을 가졌고, sample #2의 활성화 에너지는 sample #1의 최솟값보다 더 높은 약 156 kJ/mol, 20 /s의 값을 가졌다. 마지막으로 sample #3의 활성화 에너지와 pre-exponential factor는 172.25~197.44 kJ/mol과 23.21~27.87 /s의 범위로 세 샘플 중 가장 높은 값을 가졌다.
그리고 모든 샘플에서 α값이 약 0.5일 때를 기준으로 기울기가 변화하는 현상을 보였다. Sample #1은 α값이 0.5보다 작을 때 이 반응속도상수들은 점진적으로 증가하다가 α이 0.5보다 높아졌을 때 상대적으로 더 급격하게 증가하는 경향을 보였다. Sample #2의 경우 α이 0.5보다 작을 때 반응속도상수들이 감소하는 경향성을 보였으나 0.5 이상인 값을 가졌을 때, 거의 일정한 값을 유지하였다.
Sample #3은 α가 0.5보다 작을 때 증가하는 경향을, 0.5보다 큰 값을 가질 때에는 감소하는 경향을 보였다. 이러한 결과에 기초하여, α=0.5 부근에서 반응메커니즘의 변화가 일어난 것으로 추정할 수 있다.
두 번째 발열반응의 경우, 모든 THPP 샘플의 반응속도상수가 변화하는 경향을 보였지만, 세 샘플 모두 0.4 < α < 0.5 부근에서 기울기가 증가하거나 감소하였다. 따라서 모든 샘플들이 해당 범위에서 반응메커니즘의 변화가 발생함을 알 수 있다.
반응이 0에서 1로 진행할 때, sample #1의 파라미터 값들은 아래로 볼록한 형태를 뗬으며, 노화가 된 sample #2, #3은 위로 볼록한 형태를 가졌다. 다시 말해서 sample #1은 반응의 양 끝단 지점에서 가장 큰 값을 가지며, 노화된 두 샘플은 반응의 양 끝단에서 가장 작은 값을 가진다고 할 수 있다. 그리고 sample #3의 반응속도파라미터가 다른 샘플들에 비해 상당히 작은 값을 가졌으며, 0.2 < α < 0.4 부근에서 작은 변동이 있었다. 이는 이 반응구간에서 다양하고 복잡한 반응들이 발생했음을 알 수 있다.
두 번째 피크 반응의 경우 모든 샘플들은 반응 과정의 시작과 끝에서 극단적인 변동이 발생하는 것을 확인할 수 있었다. 이러한 현상은 Viton-b가 제외된 나머지 물질들의 반응이 여러 반응으로 구성되어있고, 반응이 시작되고 완료될 때 많은 화학반응들을 수반한다는 것을 의미한다. 다시 말해, α < 0.2와 α > 0.8에서 반응속도상수들이 급격한 변동을 가진 것은 안정화에 대한 영향도 있지만, 해당 범위에서 복잡한 반응들이 발생하고 있음을 말해주고 있다[21]. 따라서 앞에서 잠시 언급한대로 반응진행상수 α의 허용범위는 0.2에서 0.8로 고정시켰고, 해당 범위에서 제시된 반응속도상수들의 최대, 최솟값이 Table. 4에 명시되어있다.
본 논문에서 구한 반응속도상수들의 타당성을 검증을 위해, 기존에 제시되었던 데이터[18]와의 비교검증을 진행하였다. Shamsipur 등[18]은 TiH2를 연료로 하는 이원성 pyrotechnic 물질을 사용하였고, 이에 Kissinger method를 적용하여 반응속도상수를 구하였다.
본 논문에서 사용한 기준값은 두 가지로, 첫 번째는 29/71의 비율로 섞인 TiH2+KClO4이며 두 번째는 32.4/67.6의 비율로 섞인 TiH2+KClO3이었다. 본 논문에서는 32%의 TiH2와 63%의 KClO4의 배율을 가진 THPP 시료로 비교논문이 비슷한 연료, 산화제 비율을 가졌다고 가정하였다. 발표된 데이터와 비교하기 위해서 각 샘플을 반응 프로세스를 기준 값과 대응시킬 수 있다.
다시 말해 TiH2+KClO4에 해당하는 반응속도상수는 본 논문의 첫 번째 피크와 비교하여 THPP시료에 대해 Viton이 미치는 영향을 알 수 있으며, TiH2+KClO3에 해당하는 반응의 속도상수는 본 논문의 두 번째 피크와 비교할 수 있다.
우선, 첫 번째 발열반응에 대한 경우 모든 샘플의 경우 활성화 에너지가 최소 123.60 kJ/mol에서 최대 197.44 kJ/mol의 값을 pre-exponential factor는 최소 15.05 /s에서 최대 27.87 /s의 값을 가졌다. 해당되는 데이터인 TiH2+KClO4의 상수 값인 535.90 kJ/mol과 34.36 /s 값과 비교해보면, 실험값을 바탕으로 구한 활성화 에너지와 pre-exponential factor가 기준 값보다 작은 값을 가졌다. 그 이유로는 첫 번째로, THPP에서 Viton-b가 첨가되면 활성화 에너지와 pre-exponential factor를 감소시킨다는 것을 추측할 수 있다. 두 번째 이유로는, 바인더와 TiH2, KClO4의 화학반응 중에 산화제가 KCl과 O2로 분해되어 최종발열반응을 일으키게 된다. 이 때, 분해과정 중에 중간생성물인 KClO3가 생성되며 본반응을 나타내는 파라미터 값도 반영되어 추출되었을 것이다. 일반적으로, KClO3는 KClO4에 비해 민감하며 반응성이 좋기 때문에 반응이 일어나기 위해서는 KClO4보다 더 적은 활성화 에너지가 든다. 따라서 두 가지 사항의 복합적인 작용으로 인해 파라미터 값의 감소가 발생될 것이라 추측할 수 있다.
반면, 모든 THPP 시료의 두 번째 발열피크에 대한 활성화 에너지는 최소 198.65 kJ/mol에서 최대 315.90 kJ/mol의 값을 pre-exponential factor는 최소 24.15 /s에서 최대 44.06 /s의 값을 가진다. 활성화 에너지와 빈도인자 모두 첫 번째 발열피크에 비해 증가된 값을 보이고 있다. 제시된 기준 파라미터 데이터를 보면, TiH2+KClO3경우에 비해 TiH2+KClO4의 경우가 더 높은 파라미터 값을 가진다. 앞서 언급한 바로 알 수 있듯이, 두 번째 발열피크의 파라미터 값이 상승한 이유로 THPP 시료에 잔류하고 있던 KClO4가 반응속도 상수에 영향을 끼쳤을 것이라 판단할 수 있으며, 그 영향으로 활성화 에너지와 빈도인자가 높아짐을 추측할 수 있다.
그리고 무엇보다도 기준 시료의 조성과 실험적으로 얻은 시료의 조성에 차이가 있다. 따라서 Viton-b나 KClO3, KClO4의 영향뿐만 아니라, 성분조성의 영향 등 다양한 영향으로 인해 레퍼런스 데이터와 차이가 존재할 것이다.
3.3 XPS를 통한 정성 및 정량 분석
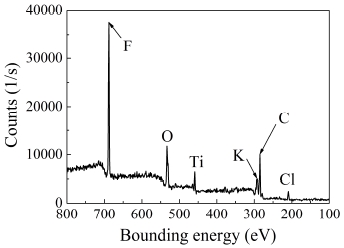
Fig. 5는 THPP 시료에 포함되어 있는 성분의 예시를 보여주는 것으로, 노화되지 않은 THPP 샘플에 대한 XPS 실험의 성분분석 결과를 나타낸다. 본 결과로부터 모든 THPP 시료에 대한 주요 성분으로 불소 (F), 산소 (O), 티타늄 (Ti), 포타슘 (K), 탄소 (C)와 염소 (Cl) 원소로 이루어져 있다는 것을 알 수 있다. 이때, 700 eV에 있는 피크는 불소에 대한 피크이며, 이때의 불소는 탄소와 수소, 불소로 이루어진 Viton-b ([-C5H8F8-]n)[22]로부터 추출된 성분임을 확인할 수 있다.
뿐만 아니라, XPS 실험으로부터 얻은 원자비율에 기초하여 정량분석[23]이 이루어졌으며, 각 THPP 샘플에 대한 화학 조성비를 구할 수 있었다. 이때, Table 5는 각 샘플의 성분 중 연료인 TiO2와 산화제인 KClO4의 비율을 의미하며, 이 값을 토대로 구한 연공비를 보여주고 있다. Sample #1은 노화가 가해지지 않았음에도 불구하고 TiO2 성분이 발견되었다. 그 이유로는 Zhang 등[24]이 보고한 연구를 들 수 있다. 본 연구진은 노화되지 않은 TiH2 입자에 대해 XPS 실험을 진행하였는데, TiH2 입자의 가장 바깥쪽 표면을 둘러싸고 있는 얇은 산화피막을 확인하였다고 기술하였다. 따라서 산화필름 층이 노화되지 않은 TiH2 입자가 공기 중에 보관될 시 형성됨을 제시한다. 따라서 참고 연구로부터, 본 연구에서 노화되지 않은 THPP 시료에서 이산화티타늄이 발견될 수 있음을 증명할 수 있다. 해당 연구 뿐만 아니라, 일반적으로 티타늄 금속은 매우 민감하고 반응성이 좋은 금속으로 알려져 있으며, 이 때 이 금속이 상온에 노출될 시에 산소와 빠르게 반응하여 얇은 산화피막에 생성됨이 알려져 있다.
그리고 본 연구에서 THPP 샘플은 32%의 TiH2, 63%의 KClO4 및 5%의 Viton-b의 질량비로 구성되어있다. 이를 몰 비로 환산해보면, TiH2와 KClO4는 1:0.709로 이루어져 있다. 이때, 각 시료의 성분 중에서 Ti와 KCl의 몰 비는 노화과정에서 발생할 수 있는 금속 산화나 산화제 분해에 관계없이 일정한 비율을 유지하기 때문에, 본 실험에서는 XPS 실험 검증 과정에서 Ti:KCl 비율을 사용하였다. #1, #2, #3에 대한 Ti:KCl 비는 1:0.708, 1:0.709, 1:0.735의 값을 가지는데, 이때의 각 시료의 몰 비의 최대 오차가 3.81% 이하로 XPS 실험으로부터 얻은 데이터가 타당함을 확인하였다.
수분 열 노화가 THPP 시료에 가해졌을 때의 영향으로는 Table 5와 Fig. 6으로부터 확인할 수 있다. 이 때, XPS는 표면분석검사이므로 TiH2 분석 시 앞서 언급한 바와 같이, 자연히 TiO2가 검출된다. 따라서 본 연구에서는 샘플 #1, #2, #2의 TiO2 증가경향을 파악하여, 연료의 산화정도를 측정하는 것을 목표로 하였다. 수분 열 노화가 가해졌을 때, TiO2는 증가하는 경향을 보였는데, 반면 KClO4는 감소하는 경향을 보였다. 그리고 노화가 진행될수록 연공비 또한 작아지는 것을 확인할 수 있다. 따라서 수분 열 노화가 THPP에 가해졌을 시에 이산화티타늄을 형성시키며, KClO4 분해 작용에 영향을 끼친다는 것을 확인할 수 있다. 또한 노화가 더 지속될수록 TiH2의 산화와 KClO4의 분해효과가 더 크게 작용함을 알 수 있으며, 아래 식(1)과 같은 반응식으로 나타낼 수 있다.
| (1) |
3.4 수분 열 노화에 따른 반응열 경향 검증
THPP 시료들에 대해 DSC로부터 추출한 발열량과 XPS로부터 구한 조성을 토대로, 이론적 발열량을 구하여 THPP 열 성능에 대한 추론이 이루어졌다. 반응열은 물질 자체에서 생산해내는 특성파라미터 중 하나로, 실제 연구에서 노화된 추진제 또는 불꽃점화제의 특성 및 성능을 비교하는 데 쓰이는 것을 확인할 수 있다 [2, 5]. 실험을 토대로 구한 반응열 (ΔH)은 AKTS software[6]를 사용하여 THPP에 대한 DSC 신호의 두 번째 발열피크에 대해 구하였으며, 베이스라인은 반응 시작과 끝의 열유량 상태를 반영하기 위해 접선형태인 것을 사용하였다.
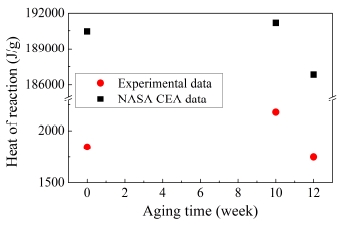
실험을 통해 구한 발열량은 Table 6과 Fig.6에서 제시된 바와 같이 sample #3, #1, #2의 순서로 증가하는 경향을 보였다. 발열량이 이 순서대로 변화하는 이유는 산화제에 대한 연료비의 트렌드를 통해 설명할 수 있다. 각 샘플에 대한 연공비는 수분 열 노화의 효과로 KClO4가 KClO3로 변하였다고 가정하여 각 시료에 대해 TiH2를 연료로 KClO4와 KClO3의 합을 산화제로 계산하여 구하였다.
Sample #2의 연공비는 0.94로 세 개의 샘플 중에서 화학양론적비 1.0에 가장 가까운 값으로 반응열이 가장 큰 값을 가질 것을 예상할 수 있으며, sample #3은 0.60으로 화학양론적비에 가장 먼 값을 가지므로 반응열이 가장 낮을 것으로 추정할 수 있다.
실험값을 검증하기 위해서, NASA CEA program[25]을 사용하여 각 샘플에 대한 이론적인 발열량을 구하였으며, 각 시료에 대해 해당하는 이론 발열량 값은 Table 6에 표기되어있다. 발열량이 고에너지 물질의 성능에 있어서 주요한 역할을 담당하기 때문에, CEA program은 이 열 성능을 추론하는 데에 사용되었다. 값 도출에 앞서, 1기압의 일정한 압력과 298.15 K의 온도에서 계산될 수 있도록 CEA 초기 값을 입력하였다. 그리고 다양한 노화 지속 기간을 갖는 THPP 샘플에 대한 반응열의 값은 XPS 실험에 의해 추출된 조성을 토대로 반영되었다. 따라서 CEA program으로 인해 구한 이론적 반응열을 DSC 실험 데이터와 비교해보며, 본 논문에서 진행한 실험의 타당성 검증을 진행하였다. 이때 각 시료의 생성 엔탈피는 Chase 등[26]과 Zumdahl 등[27]에서 제시되어있는 값을 사용하였으며, 구체적인 데이터는 Table 7에 나타나 있다.
노화가 진행됨에 따라 실험 및 CEA 데이터로부터 얻은 반응열은 그 값에 차이는 존재하지만, 비슷한 경향성을 따름을 확인할 수 있었다. 이 때, CEA 코드를 사용하여 얻은 열량은 수천 캘빈에 해당하는 단열화염온도상태까지 도달했을 때 발생하는 발열량을 의미하고, 또 실험과정에서 발생할 수 있는 열손실을 반영하지 않았기 때문에 매우 높은 발열량을 가지고 있다. 따라서 실험값과 이론값의 절대적인 비교는 어렵기 때문에 본 실험에서는 발열량의 경향성 파악에 중점을 두었다.
두 데이터 모두 sample #2의 경우 가장 높은 반응열을 가졌고, sample #3일 때에 가장 낮은 반응열 값을 가졌다. 실험데이터와 CEA 데이터의 반응열 변동 추세가 비슷했기 때문에, 적어도 0주에서 12주 사이의 반응열 값은 어느 정도 추론할 수 있다. 다시 말해 반응열은 이 노화기간동안 실제 노화실험을 진행하지 않고도 10주 노화시킨 sample #2 부근까지 발열량이 증가하여 최대발열량에 도달한 후, 감소한다는 것을 알 수 있다. 본 연구에서는 THPP 추진제에 수분 열 노화를 가할 때, 노화 기간에 따라 발열량이 선형적인 감소추세가 아니라 변동성 있는 추세를 가졌는데, 이론 발열량도 이와 같은 추세를 보여 발열량 위주로 추진제의 성능을 분석하는 데 있어서 아주 주목할 만하다고 판단하는 바이다.
4. 결 론
본 논문에서, 수분 열 노화가 가해진 THPP 시료의 열적거동과 반응속도상수를 DSC와 two-step isoconversional method를 적용하여 얻을 수 있었다. 그리고 XPS 실험과 NASA CEA program을 이용하여 THPP 시료의 이론적 발열량 경향성을 구하고, 실험값과 비교해보며 검증을 진행하였다. 그 결과 THPP의 발열량이 실험값과 이론값이 노화일수에 따라 비슷한 경향을 따른다는 것을 확인할 수 있었다.
DSC 열분석도로부터 수분 열 노화가 끼치는 영향을 보면, Viton과 연료와 산화제의 반응을 의미하는 첫 번째 피크가 노화가 진행될수록 반응이 더 높은 온도에서 발생함을 확인할 수 있었으며, 반면 두 번째와 세 번째 피크는 낮아지거나 비슷한 온도에서 반응함을 알 수 있었다. 따라서 수분 열 노화가 THPP의 반응개시지연에 관여함을 알 수 있다.
반응속도상수의 경우, 노화가 진행될수록 첫 번째 피크에 대한 활성화 에너지와 pre-exponential factor는 증가하는 경향을 보였지만, 두 번째 피크의 경우는 감소하는 경향을 보였다. 또 전체적으로 반응진행정도를 나타내는 α값이 0.2이하 0.8이상일 때에 반응속도상수들이 급격하게 변동하여 복잡한 반응이 발생함을 알 수 있었다. 또한, 해당 결과를 이전에 출판된 Shamsipur 등[18]이 연구한 논문 데이터와 비교해보면서 Viton은 THPP의 활성화 에너지와 pre-exponential factor의 값을 낮추지만, KClO4는 이러한 파라미터 값들을 증가시킴을 확인할 수 있었다.
그리고 수분 열 노화가 진행될수록, KClO4와 TiH2의 양은 감소하고, TiO2의 양은 증가함을 XPS 실험과 CEA program을 통해 증명할 수 있었다. 따라서 본 결과를 통해 수분 열 노화가 KClO4 분해반응과 TiH2의 산화작용에 촉매작용을 함을 알 수 있다.
마지막으로, XPS 실험을 통해 얻은 시료의 조성비를 NASA CEA program에 대입하여 각 THPP 시료의 이론적인 반응열을 구하였다. 이 때 sample #2의 반응열이 가장 높은 값을 가졌는데, 이는 sample #2의 F/O 비율이 화학 양론적 값에 대해 가장 가까운 값을 가졌기 때문이다. 그리고 실험 데이터의 반응열값과 비교해봄으로써, 수분 열 노화된 샘플의 반응열이 타당함을 증명하였고 0주부터 12주 사이의 발열량 변화과정을 추론해볼 수 있었다.
Acknowledgments
[이 논문은 한국추진공학회 2018년도 춘계학술대회(2018. 5. 30- 6. 1, 라마다프라자 제주호텔) 발표논문을 심사하여 수정·보완한 것임.]
본 연구는 미래창조과학부의 National Space Lab(2014M1A3A3A02034903)의 지원과 정부 (교육과학기술부)의 재원으로 한국연구재단의 지원을 받아 수행된 기초연구사업 (NRF-2016R1D1A1A02937421)입니다.
References
-
Wang, L.Q., Shi, X.J., and Wang, W.J., "The influences of combinative effect of temperature and humidity on the thermal stability of pyrotechnic mixtures containing strontium nitrate as oxidizer", Journal of Thermal Analysis and Calorimetry, 117(2), p985-992, (2014).
[https://doi.org/10.1007/s10973-014-3713-7]

-
Brown, S.D., Charsley, E.L., Goodall, S.J., Laye, P.G., Rooney, J.J., and Griffiths, T.T., "Studies on the ageing of a magnesium–potassium nitrate pyrotechnic composition using isothermal heat flow calorimetry and thermal analysis techniques", Thermochimica acta, 401(1), p53-61, (2003).
[https://doi.org/10.1016/s0040-6031(03)00055-8]

-
Poulsen, B., Rink, K., and Rink, K., "Modeling the energy release characteristics of THPP based initiators", 46th AIAA/ASME/SAE/ASEE Joint Propulsion Conference & Exhibit, Nashville, Tennessee, U.S., AIAA 2010-7007, July), (2010.
[https://doi.org/10.2514/6.2010-7007]

-
Sorensen, D.N., Quebral, A.P., Baroody, E.E., and Sanborn, W.B., "Investigation of the thermal degradation of the aged pyrotechnic titanium hydride/potassium perchlorate", Journal of Thermal Analysis and Calorimetry, 85(1), p151-156, (2006).
[https://doi.org/10.1007/s10973-005-7365-5]

-
Trache, D., and Khimeche, K., "Study on the influence of ageing on thermal decomposition of double‐base propellants and prediction of their in‐use time", Fire and Materials, 37(4), p328-336, (2013).
[https://doi.org/10.1002/fam.2138]

- Kim, Y., Park, J., Kwon, K., and Yoh, J.J., "Characterization of energetic materials using thermal calorimetry", Journal of the Korean Society of Propulstion Engineers, 20(2), p547-553, (2017).
-
Bart, F., Guittet, M.J., Henriot, M., Thromat, N., Gautier, M., and Duraud, J.P., "Surface-Analysis of Wide-Gap Insulators with XPS", Journal of Electron Spectroscopy and Related Phenomena, 69(3), p245-258, (1994).
[https://doi.org/10.1016/0368-2048(94)02191-2]

-
H.L. Friedman, "Kinetics of thermal degradation of char‐forming plastics from thermogravimetry. Application to a phenolic plastic", Journal of Polymer Science: Polymer Symposia, 6(1), p183-195, (1964).
[https://doi.org/10.1002/polc.5070060121]

- Dellavedova, M., Pasturenzi, C., Gigante, L., and Lunghi, A., "Kinetic evaluations for the transportation of dangerous chemical compounds", CHEMICAL ENGINEERING, 26, p585-590, (2012).
-
Flynn, J.H., and Wall, L.A., "General treatment of the thermogravimetry of polymers", Journal of Research of the National Bureau of Standards, 70(6), p487-523, (1966).
[https://doi.org/10.6028/jres.070a.043]

-
Ozawa, T., "A New Method of Analyzing Thermogravimetric Data", Bulletin of the Chemical Society of Japan, 38(11), p1881-1886, (1965).
[https://doi.org/10.1246/bcsj.38.1881]

- American Institute of Aeronautics and Astronautics (AIAA), “Standard: Criteria for Explosive Systems and Devices on Space and Launch Vehicles”, AIAA S-113-2005, (2005).
-
Babar, Z.U.D., and Malik, A.Q., "Accelerated ageing of SR‐562 pyrotechnic composition and investigation of its thermo kinetic parameters", Fire and Materials, 41(2), p131-141, (2017).
[https://doi.org/10.1002/fam.2371]

-
Guo, S., Wang, Q., Sun, J., Liao, X., and Wang, Z.S., "Study on the influence of moisture content on thermal stability of propellant", Journal of Hazardous and Materials, 168(1), p536-541, (2009).
[https://doi.org/10.1016/j.jhazmat.2009.02.073]

-
Vyazovkin, S., Burnham, A.K., Criado, J.M., Perez-Maqueda, L.A., Popescu, C., and Sbirrazzuoli, N., "ICTAC Kinetics Committee recommendations for performing kinetic computations on thermal analysis data", Thermochimica Acta, 520(1-2), p1-19, (2011).
[https://doi.org/10.1016/j.tca.2011.03.034]

-
Vyazovkin, S., Chrissafis, K., Di Lorenzo, M.L., Koga, N., Pijolat, M., Roduit, B., Sbirrazzuoli, N., and Suñol, J.J., "ICTAC Kinetics Committee recommendations for collecting experimental thermal analysis data for kinetic computations", Thermochimica Acta, 590(1), p1-23, (2014).
[https://doi.org/10.1016/j.tca.2014.05.036]

-
Lyon, R.E., Safronava, N., Senese, J., and Stoliarov, S.I., "Thermokinetic model of sample response in nonisothermal analysis", Thermochimica Acta, 545(1), p82-89, (2012).
[https://doi.org/10.1016/j.tca.2012.06.034]

-
Shamsipur, M., Pourmortazavi, S.M., Roushani, M., and Miran Beigi, A.A., "Thermal Behavior and Non-Isothermal Kinetic Studies on Titanium Hydride–Fueled Binary Pyrotechnic Compositions", Combustion Science and Technology, 185(1), p122-133, (2013).
[https://doi.org/10.1080/00102202.2012.709564]

-
Lu, K.T., and Yang, C.C., "Thermal Analysis Studies on the Slow‐Propagation Tungsten Type Delay Composition System", Propellants, Explosives, Pyrotechnics, 33(5), p403-410, (2008).
[https://doi.org/10.1002/prep.200700287]

-
Rudloff, W.K., and Freeman, E.S., "Catalytic effect of metal oxides on thermal decomposition reactions. II. Catalytic effect of metal oxides on the thermal decomposition of potassium chlorate and potassium perchlorate as detected by thermal analysis methods", The Journal of Physical Chemistry, 74(18), p3317-3324, (1970).
[https://doi.org/10.1021/j100712a002]

-
Liu, H., He, P., Feng, J.C., and Cao, J., "Kinetic study on nonisothermal dehydrogenation of TiH2 powders", International Journal of Hydrogen Energy, 34(7), p3018-3025, (2009).
[https://doi.org/10.1016/j.ijhydene.2009.01.095]

-
Koch, E.C., "Metal‐Fluorocarbon‐Pyrolants IV: Thermochemical and Combustion Behaviour of Magnesium/Teflon/Viton (MTV)", Propellants, explosives, pyrotechnics, 27(6), p340-351, (2002).
[https://doi.org/10.1002/prep.200290004]

-
Takabayashi, S., Motomitsu, K., and Takahagi, T., "Qualitative analysis of a diamondlike carbon film by angle-resolved x-ray photoelectron spectroscopy", Journal of Applied Physics, 101(10), p103542, (2007).
[https://doi.org/10.1063/1.2735416]

-
Zhang, Y.G., Wang, C.M., Liu, Y., Liu, S.P., Xiao, S.F., and Chen, Y.G., "Surface characterizations of TiH2 powders before and after dehydrogenation", Applied Surface Science, 410(1), p177-185, (2017).
[https://doi.org/10.1016/j.apsusc.2017.03.077]

- Gordon, S., and McBride, B.J., “Computer Program for Calculation of Complex Chemical Equilibrium Compositions and Applications: I. Analysis”, NASA, Cleveland, O.H., U.S.A., NASA RP-1311, (1994).
- Chase, M.W., National Institute of S, Technology. NIST-JANAF thermochemical tables, 4th ed., American Institute of Physics for the National Institute of Standards and Technology, Woodbury, N.Y., Thermochemistry Tables (1998).
- Zumdahl, S., and DeCoste, D.J., Chemical principles, 7th ed., Cengage Learning, 20 Channel Center Street Boston, USA, CH. 9, (2012).