흐름형 반응기 내에서 액체연료의 흡열반응촉매 종류에 따른 비활성화 정도에 대한 연구
Copyright Ⓒ The Korean Society of Propulsion Engineers
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
초록
극초음속 비행체에서는 공기와의 마찰열과 엔진열의 증가로 기체 내부의 열적 부하가 발생한다. 이는 비행체 내부 구조물의 변형을 일으키고 오작동을 발생시킬 수 있다. 흡열연료는 액체 탄화수소 연료로써 흡열반응을 통해 열을 흡수할 수 있는 연료이다. 본 연구에서는 실제 반응조건과 비슷한 고정층 흐름형 반응기에서 Exo-tetrahydrodicyclopentadiene(exo-THDCP)를 연료로 사용하여 흡열 촉매 종류에 따른 흡열 반응 시 생성물, 코크 생성량과 촉매 특성 변화 간 관계에 대한 연구를 수행하였다.
Abstract
In hypersonic aircraft, increase of aerodynamic and engine heat lead thermal load in airframe. It could lead structural change of aircraft’s component and malfunctioning. Endothermic fuels are liquid hydrocarbon fuels which absorb the heat load by undergoing endothermic reactions. In this study, we investigated the relationship between product, coke formation and catalytic properites of endothermic catalysts by using exo-tetrahydrodicyclopentadiene as a fuel in a fixed bed flow reactor similar to the actual reaction conditions.
Keywords:
Hypersonic Aircraft, Endothermic Fuel, Zeolite, Flow Reactor, Exo-tetrahydrodicyclopentadiene키워드:
극초음속 비행체, 흡열연료, 제올라이트, 흐름형 반응기, exo-THDCP1. 서 론
초음속 비행체나 발사체는 초음속 비행 속도 때문에 공기와의 마찰과 엔진에서 발생하는 열이 극심하다. 이에 발생되는 열로 인해 비행체의 온도가 상승하게 되는데, 발생한 열은 엔진의 구조 변화와 기능 저하를 일으킬 수 있다. 따라서 이를 방지하기 위해 엔진의 열을 냉각시킬 수 있는 냉각시스템의 개발이 중요하다.
초음속비행체의 열 관리를 위한 냉각기술로는 공기를 이용한 공냉각식 냉각법과 액체 메탄이나 액체 수소와 같은 극저온 연료 사용법이 있다. 그러나 공냉각식 냉각법은 극초음속 비행에서 공기와의 마찰열을 더 증가시키고, 극저온 연료는 낮은 밀도로 인하여 저장을 위한 거대한 기계장치가 필요하고, 비용이나 안전 등의 문제가 있다[1]. 따라서 최근에는 열부하 증가로 인한 극초음속 비행체를 냉각시키기 위한 방법으로 탄화수소형 흡열연료가 대안으로 주목받고 있다.
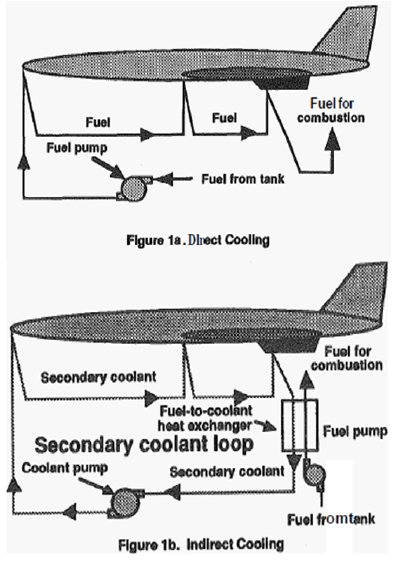
흡열연료란 극초음속 비행체 냉각을 위해 열분해반응 또는 촉매분해반응을 통해 열을 흡수하면서 분해가 되는 특성을 지닌 연료를 말한다. 흡열연료로부터 얻을 수 있는 흡열량은 물리적인 흡열과 화학적인 흡열로 나뉜다. 물리적 흡열이란 연료의 온도 상승을 통해 흡수되는 현열(sensible heat)이고 화학적 흡열은 연료의 화학 반응에 의해 흡수되는 반응열(heat of reaction)이다[2]. 흡열연료를 이용한 냉각은 Fig. 1에 나타낸 것처럼 직접냉각(direct cooling)과 간접냉각(indirect cooling) 두 가지 방식으로 나뉜다[1]. 직접냉각은 연료가 연소실에 투입되기 전 노즐벽면 내의 유로를 흐르면서 가열된 시스템을 냉각하는 방식이다. 간접냉각은 흡열연료가 시스템 외부에 설치된 열교환기 내에서 분해반응을 통해 사용된 냉각제를 다시 냉각시켜 이를 이용해 시스템의 열을 흡수하는 방식이다. 본 연구에서는 흡열연료로 exo-tetrahydrodicyclopentadien (exo-THDCP)를 사용하였다. exo-THDCP에 관한 물성은 Table 1에 나타내었다.
흡열연료의 흡열량을 향상시키기 위한 촉매로 제올라이트 촉매를 사용한다. 제올라이트 촉매는 흡열연료의 전환율을 높여서 흡열량을 증가시키는 역할을 하는데 반응시간이 길어질수록 촉매의 비활성화가 진행되어 전환율이 떨어지면서 흡열량이 감소하는 현상이 발생한다. 이러한 촉매의 비활성화의 유형으로는 촉매의 산점을 선택적으로 피독하는 선택적 피독 (selective poisoning), 비선택적 피독(non-selective poisoning), 활성점이 떨어져 나가는 침출(leaching), 소결(sintering), 코크 성분에 의해 기공입구나 기공내부 통로가 막히는 현상(fouling), 그리고 촉매 일부가 떨어져 나가는 마멸(attrition) 등이 존재한다[3].
위의 촉매의 비활성화 유형들에 의한 흡열량 감소를 방지하고자 촉매의 비활성화 방지에 대한 연구가 필요하나 이에 대한 연구는 부족하다.
본 연구에서는 두가지 유형의 상용촉매를 사용하여 흡열반응 시 생성물 및 촉매의 코크 생성량과 촉매 특성 간의 관계, 그리고 각 촉매의 비활성화의 경향에 대하여 고찰해 보았다.
2. 실험 방법
2.1 흡열촉매
본 연구에서는 두 종류의 제올라이트 촉매를 사용하여 비활성화 정도를 측정하였다. 첫 번째 제올라이트 촉매는 Y 유형의 상용 제올라이트 (CBV 300)이고 두 번째 촉매는 ZSM-5 유형의 상용 제올라이트 (CBV 2314)이다. 두 상용제올라이트는 NH4+ 형태(ammonium form)이므로 H+(H form)으로 바꿔주기 위해 550 ℃에서 6시간 소성과정과 금속담지 시킨 후 흡열량 측정 실험을 진행하였다. 각 촉매의 BET 측정을 통한 BET 표면적(surface area), 중기공(mesopore), 및 미세기공(micropore)에 대한 기공특성 결과는 Table 2에 나타내었다.
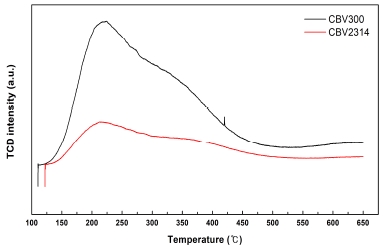
또한 각 제올라이트 촉매들을 NH3-TPD (ammonia-temperature programmed desorption) 분석하여 얻은 산점 (acid sites)특성 결과는 Fig. 2 와 Table 3에 나타내었다.
이후 가루형태의 제올라이트를 Fig. 3와 같이 지름 3 mm, 높이 1 mm의 disk 형태로 성형하여 실험에 사용하였다.
2.2 흡열 반응 실험
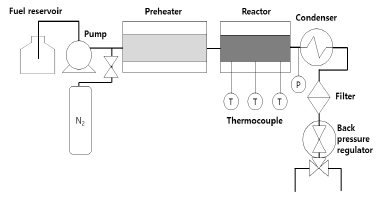
흐름형 반응기에서 촉매에 의한 흡열 분해 반응 실험을 수행하기 위해서 Fig. 4와 같은 반응기에서 실험을 수행하였다. 예열기 부분의 내부 직경은 1.175 mm 이고 반응기 부분의 내부 직경은 7.525 mm 이다. 예열기 부분의 온도를 500 ℃로 설정하여 예열기 출구에서 연료를 400℃까지 상승시켜 준 후, 반응기 부분에서 550℃로 가열하여 촉매에 의한 연료의 분해반응 실험을 수행하였다.
이후 연료의 열분해 과정에서 산소의 존재는 큰 영향을 미치므로 산소를 제거하기 위해서 해당 온도에 도달했을 시, 반응기 내부로 질소를 10 분간 흘려보낸다[5, 6]. 그리고 후단압력조절기(back pressure regulator)를 사용하여 내부압력을 50 bar로 조절한 후 , 연료인 exo-THDCP를 고압펌프로 3 ml/min의 유량으로 흘려보내준다. 이때, 반응기 내에 촉매를 넣지 않은 경우와, 촉매를 0.9750 g 정도를 채워 넣은 경우의 전력 변화를 측정한다. 이후 15 분 간격으로 액상 생성물을 채취한다. 시료는 GC-MSD (Agilent 7890N/5975A MSD, HP-5ms column)로 초기 오븐온도 40 ℃에서 최종온도 320 ℃까지 10 ℃/min으로 온도를 상승시킨 후 30 분 동안 오븐온도를 유지시켜 성분을 분석한다.
2.3 코크 생성량 분석 (Analysis of production of coke)
흡열반응 종료 후, disk 형태의 촉매를 가루형태로 만든 다음 TGA 분석을 통하여 코크생성량을 측정한다. TGA 분석 조건은 다음과 같다.
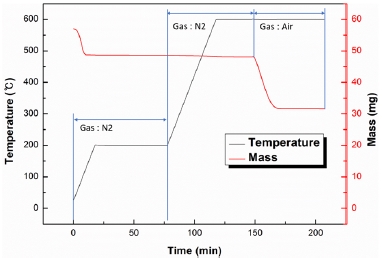
우선 촉매에 존재하는 연료를 제거하기 위해 질소 조건 하에서 온도를 10 ℃/min으로 200 ℃까지 상승 후, 1시간동안 유지한다. 이후 coke precursors 측정을 위해 질소 조건 하에서 온도를 10 ℃/min으로 600 ℃까지 상승 후, 30 분 동안 유지한다. 최종적으로 coke 질량 측정을 위하여 동일온도에서 기체 조건을 에어(air)로 전환하여 1시간 동안 유지한다[7]. 이와 같이 진행한 TGA의 온도 설정과 질량 변화에 대한 그래프는 Fig. 5에 나타나있다.
3. 실험 결과
3.1 촉매에 의한 전환율 (Conversion)
제올라이트 촉매의 흡열량 측정 실험조건은 반응기 외부 온도 550 ℃, 압력 50 bar, 172.43 hr-1(WHSV)에서 수행되었다. 촉매를 반응기에 넣은 상태에서 연료를 흘려주면서 열분해 과정에서의 전환율의 경우 다음의 식 (1)에 의하여 구한다.
| (1) |
반응이 끝난 후 연료의 질량을 측정하는 방법은 다음과 같다. 반응이 끝나고 나오는 생성물을 1 분간 받아서 질량을 측정한다. 그리고 1 분 동안 반응기로 들어가는 연료의 질량에서 빼준 후, GC/MS로 측정한 반응 후 생성물 내 연료의 비율을 곱해주어서 최종 연료의 질량을 구한다.
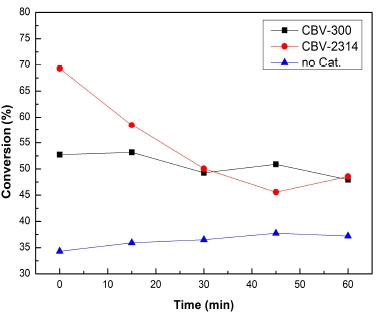
Fig. 6은 CBV-300과 CBV-2314 촉매를 사용했을 때와 촉매를 넣지 않고 흡열 분해 반응 시 전환율의 그래프이다. 촉매를 사용했을 때는 확실히 촉매를 넣지 않았을 때보다 전환율이 월등하게 높게 나온 것을 확인할 수 있다. CBV-300과 CBV-2314의 전환율을 비교해 보면 초기 전환율에 있어서 CBV-2314의 값이 훨씬 높은 값을 나타내고 있다.
3.2 시간별 생성물의 탄소수별 정리
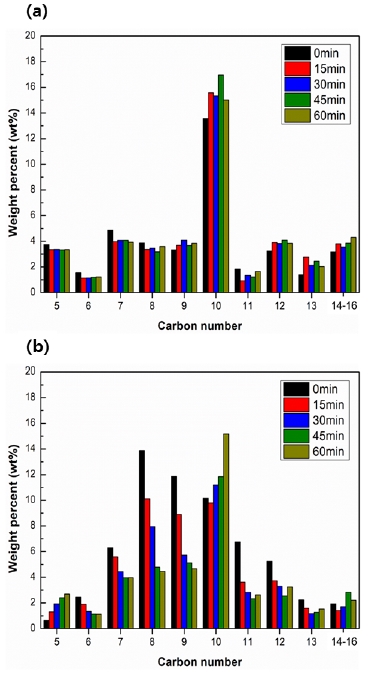
Fig. 7은 GC-MSD로 측정한 액상 생성물을 탄소수가 10인 exo-THDCP의 비율은 제외한 후, 탄소수별로 정리한 그래프이다. (a)는 CBV-300, (b)는 CBV-2314 촉매를 사용했을 때의 생성물의 분석 결과이다. CBV-300의 경우 탄소수가 10인 생성물이 많은 것을 보아 연료가 분해 과정 중에 대부분이 C-10의 이성질체로 변화했음을 알 수 있다. 또한 0 분에서 60 분 동안 반응시간이 지나도 큰 변화는 보이지 않았다.
그러나 CBV-2314에서는 반응시간 초기에서 C-6부터 9까지에서 높은 값을 보이나 반응시간이 지날수록 감소하고 C-10의 성분은 증가하는 경향을 보인다. 이는 Fig. 6의 전환율의 그래프의 경향과 연관이 있다. 촉매의 비활성화가 진행되기 전에는 반응물의 탄소수보다 작은 물질로 분해가 진행되나 비활성화가 진행되면서 분해된 생성물이 탄소수가 보다 높은 물질로 전환된다. 또한 탄소수가 6에서부터 9까지의 비율은 반응시간 0 분에서 30 분까지 급격하게 하락하다가 45 분과 60 분에서는 하락하는 크기가 감소한다. 이는 0 분에서 30 분까지의 전환율이 크게 감소하다가 45 분과 60 분에서의 전환율이 큰 차이가 없다는 것을 보아 반응시간이 길어질수록 촉매의 비활성화가 진행되면서 고분자량의 연료를 저분자량의 물질로 분해할 수 있는 성능을 잃고, 이에 전환율도 하락하게 된다고 유추할 수 있다. 저분자로 분해하는 성능이 저하되는 것은 분해과정에서 주변으로부터 흡수하는 열이 감소한다는 것을 의미하므로 이로 인하여 흡열량이 감소하게 될 것을 유추할 수 있다.
3.3 코크 생성량
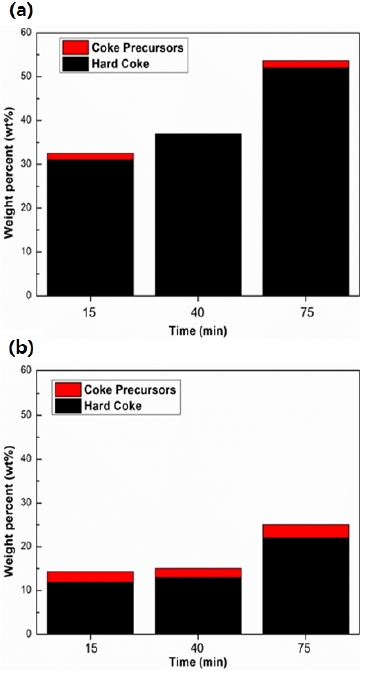
반응이 끝난 각 촉매 샘플을 TGA로 분석한 결과는 Fig. 8에 나타나 있다. 두 제올라이트 촉매에서 동일하게 반응시간이 길어질수록 코크 생성량이 증가하는 것을 확인하였다.
CBV-300의 경우, 초기부터 코크 생성량이 CBV-2314보다 큰 것을 볼 수 있다. 이는 CBV-300의 초기 전환율과 흡열량이 CBV-2314보다 낮은 결과에 대한 추가적인 원인이 될 수 있다.
두 촉매 간 코크 생성이 다른 원인에 대해서는 우선 CBV-300의 산점 밀도가 CBV-2314보다 월등하게 커서 반응 초기부터 급격하게 코크가 발생되었다고 유추할 수 있다.
3.4 BET 분석 결과
Fig. 9는 반응 시간에 따른 촉매의 BET 분석 결과이다. (a)는 BET 표면적, (b)는 미세기공의 부피, 그리고 (c)는 중기공의 부피이다. BET 분석 결과에서 CBV-300의 경우에는 반응시간 15 분 후 Table 2에 명시된 반응 전 기공 특성 값보다 큰 폭으로 감소했음을 확인할 수 있다. 그리고 반응시간 15 분, 40 분 그리고 75 분에서 비표면적, 미세기공, 중기공 부피의 변화가 그리 크지 않음을 보아 반응 초기에 코크에 의해 촉매 표면에 급속히 코크가 형성되었음을 유추할 수 있다.
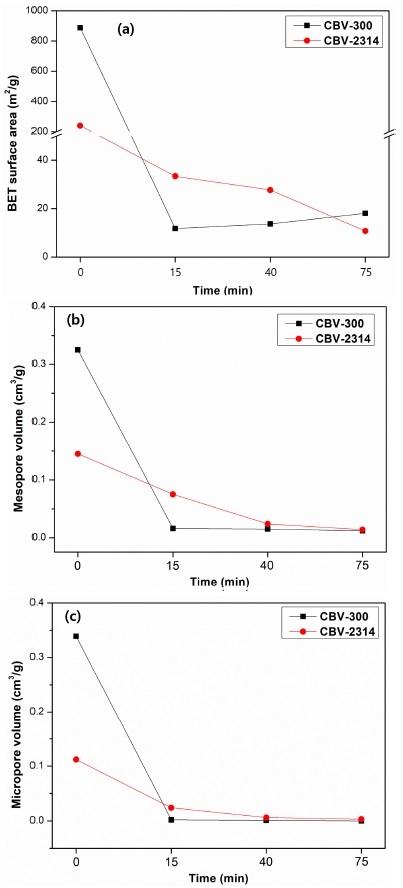
BET analysis results of zeolite after reaction; (a): BET surface area, (b): Mesopore volume, (c): Micropore volume.
CBV-2314의 경우, 반응시간 15 분, 40 분, 75 분에서 비표면적, 미세기공, 중기공 부피가 계속 감소한다. 이는 반응시간 15 분에서도 촉매의 기공 성능은 아직 존재함을 의미하며 Fig. 6의 반응시간에 따른 전환율 그래프에서 CBV-300의 경우 전환율의 변화가 크게 발생하지 않았던 것에 비하여 CBV-2314의 경우 반응 시간 초기에서부터 반응 종료 때까지 감소하는 현상에 대한 원인이 될 것이다.
References
-
D.R. Sobel, and L.J. Spadaccini, "Hydrocarbon Fuel Cooling Technologies for Advanced Propulsion", Journal of Engineering for Gas Turbines and Power, 119(2), p344-351, (1997).
[https://doi.org/10.1115/1.2815581]

-
Hyeon, D.H., Kim, J.Y., Chun, B.H., Kim, S.H., Jeong, B.H., and Han, J.S., "Improvement of Heat of Reaction of Jet Fuel Using Pore Structure Controlled Zeolite Catalyst", Journal of the Korean Society of Propulsion Engineers, 18(5), p95-100, (2014).
[https://doi.org/10.6108/kspe.2014.18.5.095]

- J.A. Moulijn, A.E van Diepen, and F. Kapteijin, "Catalyst Deactivation: is it Predictable? What to do?", Applied Catalysis A: General, 212(30), p3-16, (2001).
-
Petley, D., Jones, S., and Dziedzic, W., "Analysis of Cooling Systems for Hyersonic Aircraft", 3rd international Aerospace Planes Conference, Orlando, F.L., U.S.A., AIAA 91-5063, December), (1991.
[https://doi.org/10.2514/6.1991-5063]

-
Z. Wang, Y.s. Guo, and R.S. Lin, "Pyrolysis of Hydrocarbon Fuel ZH-100 Under Different Pressures", Journal of Analytic and Applied Pyrolysis, 85(1-2), p534-538, (2009).
[https://doi.org/10.1016/j.jaap.2009.01.009]

- J. Qin, S. Zhang, W. Bao, W. Zhou, and D. Yu, "Thermal Management Method of Fuel in Advanced Aeroengines", Energy, 49(1), p459-468, (2012).
-
S. Chen, and G. Manos, "Study of Coke and Coke Precursors During Catalytic Cracking of n-Hexane and 1-Hexene over Ultrastable Y Zeolite", Catalyst Letters, 96(3-4), p195-200, (2004).
[https://doi.org/10.1023/b:catl.0000030120.29538.5d]